Neuer Mechanismus der Genregulation entschlüsselt
Doppelte Produktivität
Die Anzahl der Gene von Mensch, Maus, und Fruchtfliege ist mit etwa 20.000 fast identisch und kann alleine die Unterschiede zwischen den Organismen nicht erklären. Für die Evolution ist also nicht nur die Genzahl, sondern wesentlich auch die Regulation der Gene entscheidend. Beim Ablesen der DNA entsteht in einem ersten Schritt zunächst mRNA, die anschließend als Vorlage für die Herstellung von Proteinen dient. Die Proteinherstellung wird dabei reguliert, indem regulatorische Proteine an die mRNA binden. Wie diese Proteine die RNA spezifisch erkennen, war bisher aber im Wesentlichen unverstanden.
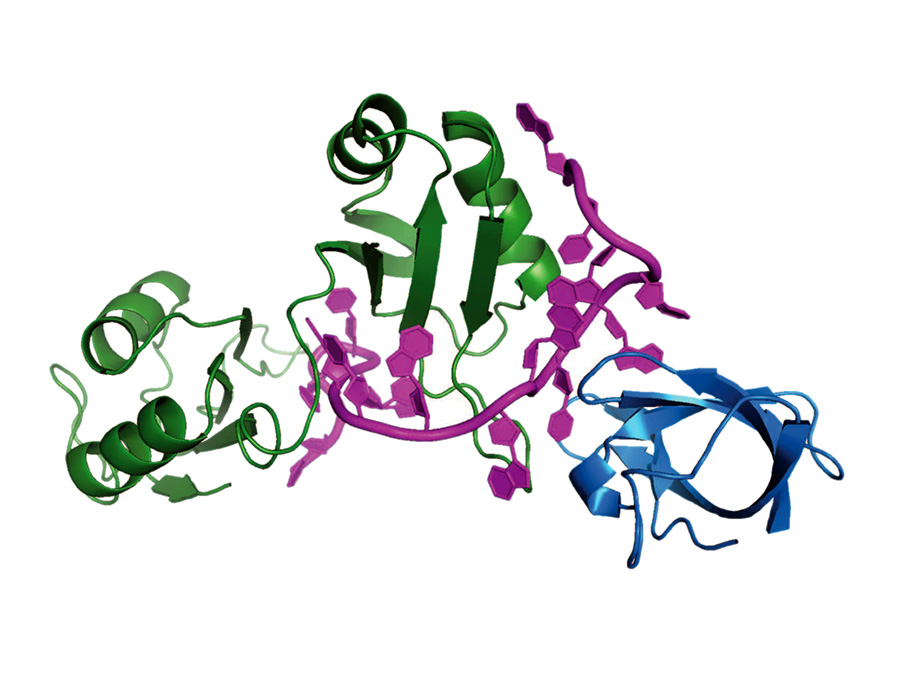
Ein internationales Team unter Federführung des Helmholtz Zentrums München (HMGU) und der Technischen Universität München (TUM) hat nun die Raumstruktur eines solchen regulatorischen Protein-RNA-Komplexes bestimmt. Die Wissenschaftler untersuchten am Modell der Fruchtfliege die Bildung eines spezifischen Komplexes der regulatorischen Proteine Sxl (Sex-lethal) und Unr (Upstream-of-N-Ras) mit Boten-RNA.
Dieser Proteinkomplex sorgt dafür, dass die Expression von Genen, die auf dem einzigen männlichen (XY) X-Chromosom lokalisiert sind, zweimal größer ist als die der X-Chromosomen in weiblichen (XX) Fruchtfliegen. Dadurch wird eine vergleichbare Proteinkonzentration erreicht, die für die Fruchtfliegen lebensnotwendig ist.
Paradigma für die Genregulation
Die räumliche Struktur des Protein-RNA Komplexes zeigt nun, wie mehrere Proteine zusammenarbeiten, um eine hochspezifische Erkennung der mRNA zu ermöglichen. „Unsere Ergebnisse stellen ein Paradigma für die Regulation vieler essentieller zellulärer Prozesse auf der Ebene der Boten-RNA dar“, erklärt Sattler, Inhaber des Lehrstuhls für Biomolekulare NMR-Spektroskopie der TUM und Leiter des Instituts für Strukturbiologie am HMGU.
Die spezifische Erkennung der Boten-RNA wird durch die Kooperation mehrerer RNA-bindender Proteine ermöglicht, obwohl jedes der beteiligten Proteine für sich alleine weniger spezifisch mit RNA wechselwirkt und an der Regulation anderer Zellprozesse beteiligt ist. Durch die Kombination mehrerer Proteine kann so eine Vielzahl von biologischen Prozessen auf der Ebene der mRNA mit einer relativ kleinen Zahl von regulatorischen RNA-bindenden Proteinen reguliert werden.
Die Autoren gehen davon aus, dass dieses Prinzip einen essentiellen und weitverbreiteten Mechanismus der Genregulation in allen höheren Organismen darstellt. Mutationen beziehungsweise Missregulation der beteiligten Proteine können dementsprechend die Entstehung von Krankheiten zur Folge haben.
Die Arbeiten führten Wissenschaftler um Dr. Janosch Hennig, Dr. Grzegorz Popowicz und Professor Dr. Michael Sattler gemeinsam mit der Arbeitsgruppe von Dr. Fátima Gebauer am Centre for Genomic Regulation (Barcelona, Spanien) und Kollegen am Institut Biologie Structurale (Grenoble, Frankreich) durch. Röntgenstrukturanalyse und Kernspinresonanz (NMR) Spektroskopie-Untersuchungen fanden am Institut für Strukturbiologie des HMGU und am Bayerischen NMR Zentrum statt. Die Röntgen-Kleinwinkelstreuungsexperimente wurden am Institut Laue-Langevin und am Institut Biologie Structurale (Grenoble, France) durchgeführt.
Publikation:
Hennig, J. et al., Structural basis for the assembly of the SXL-UNR translation regulatory complex, Nature, DOI: 10.1038/nature13693
Kontakt:
Prof. Dr. Michael Sattler
Technische Universität München
Lehrstuhl für Biomolekulare NMR-Spektroskopie
Lichtenbergstr. 2, 85748 Garching, Germany
Tel.: +49 89 289 13867 – E-Mail – Internet
Technische Universität München
Corporate Communications Center
- Dr. Nadja Becker (HMGU) / Dr. Andreas Battenberg (TUM)
- battenberg@zv.tum.e
- presse@tum.de
- Teamwebsite