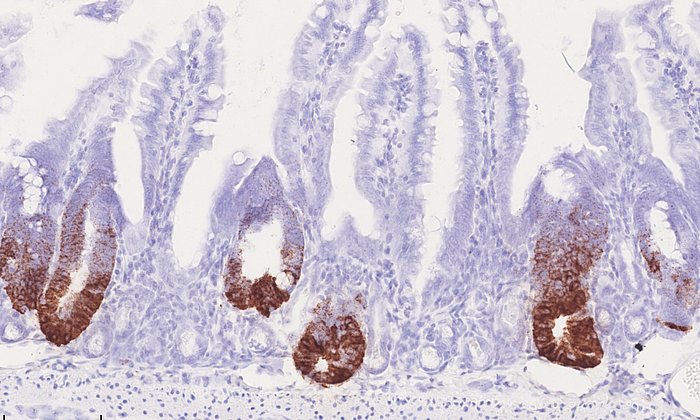
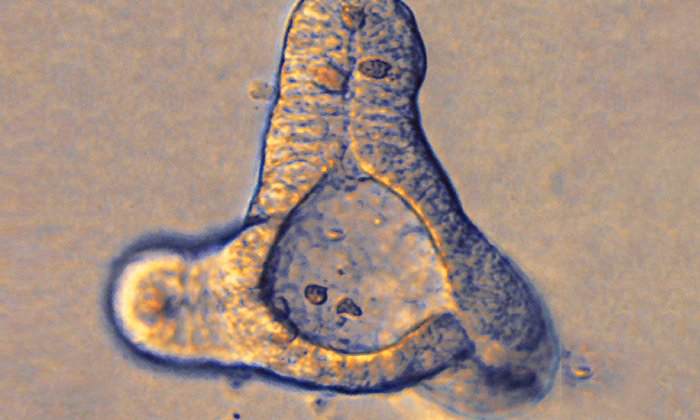
Wie Zellen miteinander arbeiten, um sich in menschliches Lebergewebe zu entwickeln
Labor-Lebern ahmen natürliche Entwicklungsabläufe nach
„Transplantierbare Lebern und Lebergewebe biotechnologisch herzustellen, wäre ein großer Gewinn für Menschen, die an Lebererkrankungen leiden und innovative Behandlungen benötigen, um ihr Leben zu retten“, sagt Takanori Takebe, Forscher am Cincinnati Children’s Hospital Medical Center und der Yokohama City University. „Unsere Daten verschaffen uns jetzt ein neues, detailliertes Verständnis der interzellulären Kommunikation zwischen den sich entwickelnden Leberzellen und zeigen, dass wir menschliche Leberdivertikel herstellen können, die fetalen Zellen in ihrer natürlichen Entwicklung bemerkenswert ähnlich sind.“
Für die aktuelle Studie veröffentlicht in "Nature" nutzte das Forscherteam eine Technologie, die sich single-cell RNA sequencing (Einzelzell-RNA-Sequenzierung) nennt und mit deren Hilfe sie messen können, wie individuelle Zellen sich verändern, wenn sie in einer dreidimensionalen Mikroumgebung miteinander kombiniert werden, in der Gefäßzellen, Bindegewebszellen und Leberzellen auf komplexe Art miteinander kommunizieren.
Wissenschaftler belauschen Unterhaltung von Zelle zu Zelle
„Der größte Vorteil der Single-cell-RNA-Sequencing-Technologie ist, dass sie uns für alle Zelltypen Genaktivitätskarten liefert, und wir so ihre Unterhaltung belauschen können“, sagt Keisuke Sekine von der Yokohama University, einer der beiden Erstautoren der Studie. Die Forscher konzentrierten sich darauf, für jede einzelne dieser Zellarten jeweils vor und nach ihrem Zusammentreffen zur Bildung von Leberkeimzellgewebe einen kompletten Bauplan der aktiven Transkriptionsfaktoren, Signalmoleküle und -rezeptoren zu entwickeln.
Dabei beobachteten sie, dass sich die Konversation und das Verhalten der Zellen drastisch verändern, sobald sie sich in der dreidimensionalen Umgebung zusammen entwickeln. „Es war aufregend, erstmals zu sehen, wie einzelne Zellen aufeinander reagieren, wenn sie in dieselbe Umgebung innerhalb der Leberkeimzelle gebracht werden. Das ähnelt dem Beobachten von Menschen auf einer Party“, sagt Gray Camp vom Max-Planck-Institut für evolutionäre Anthropologie, der andere der beiden Erstautoren der Studie.
Die Single-cell-RNA-Sequencing-Analyse half den Forschern dabei, die aus Stammzellen im Labor hergestellten dreidimensionalen Lebergewebe mit natürlich vorkommenden menschlichen fetalen und adulten Leberzellen zu vergleichen und ins Verhältnis zu bringen. Die Forscher beobachteten, dass ihre im Labor gezüchteten Leberdivertikel über molekulare und genetische Signaturen verfügten, die sehr stark den Signaturen ähneln, die in sich natürlich entwickelnden menschlichen Leberzellen vorhanden sind. „Unser Daten zeigen in einer vortrefflichen Auflösung, dass die Kommunikation zwischen Zellen unterschiedlichen Typs die einzelnen Zellen auf eine Art und Weise verändert, wie es möglicherweise auch während der natürlichen Entwicklung einer menschlichen Leber passiert“, sagt Professorin Barbara Treutlein von der TUM.
Insbesondere analysieren die Forscher die Wechselwirkung zwischen einem Signalprotein, das von Zellen produziert wird, um die Herausbildung von Blutgefäßen anzuregen (VEGF), und einem Rezeptorprotein, das mit VEGF kommuniziert, um die Blutversorgung innerhalb der sich entwickelnden Leber anzuregen (KDR). Wie die aktuelle Studie zeigt, liefert das Zusammenspiel dieser beiden Eiweiße äußerst wichtige Instruktionen zur Entwicklung und Reifung von Lebergewebe. Die Forscher schauten sich dieses Wechselspiel an, während sich die Leberzellen von Mäusen, natürliche menschliche Leberzellen und ihre biotechnologisch hergestellten Lebern entwickelten.
Dabei bemerkten die Autoren auch, dass die Genexpression – wo und wann genau Gene abgeschrieben werden – in den aus Stammzellen hergestellten Leberzellen nicht ganz mit der Genexpression bei natürlichen menschlichen Leberzellen übereinstimmt. Den verbleibenden Lücken zwischen natürlichen und biotechnologisch hergestellten Geweben liegen höchstwahrscheinlich Unterschiede in den Entwicklungssignalen zugrunde, die von der einzigartigen Mikroumgebung der Petrischale im Vergleich zum sich entwickelnden Menschen oder Tier ausgelöst werden.
Das Ziel: Funktionstüchtige menschliche Leber aus der Petrischale
Die neuen zellulären und molekularen Daten der aktuellen Studie sollen künftig dazu dienen, Leberknospen-Organoide weiterhin zu verbessern und die Differenzierung aller Zelltypen, die bei der Entwicklung der menschlichen Leber in Aktion treten, genauestens zu rekapitulieren. „Es gibt noch viel darüber zu lernen, wie man am besten eine funktionstüchtige menschliche Leber in der Petrischale herstellt“, sagt Treutlein. „Doch unsere Studie ist ein großer Schritt in diese Richtung.“
Publikation:
J. Gray Camp,, Keisuke Sekine, Tobias Gerber, Henry Loeffler-Wirth, Hans Binder, Malgorzata Gac, Sabina Kanton, Jorge Kageyama, Georg Damm, Daniel Seehofer, Lenka Belicova, Marc Bickle, Rico Barsacchi, Ryo Okuda, Emi Yoshizawa, Masaki Kimura, Hiroaki Ayabe, Hideki Taniguchi, Takanori Takebe und Barbara Treutlein: Multilineage communication regulates human liver bud development from pluripotency, Nature 546, Juni 2017. DOI:10.1038/nature22796
Kontakt:
Prof. Dr. Barbara Treutlein
Technische Universität München
Professur für Single Cell Genomics
Tel: +49 (341) 3550 864
E-Mail: barbara.treutlein@tum.de
Technische Universität München
Corporate Communications Center
- Sabine Letz/ MPG
- letz@zv.tum.de
- presse@tum.de
- Teamwebsite