Mutationen in Plasmazellen spielen wichtige Rolle bei Leichtketten-Amyloidose
Tödliche Überproduktion von Antikörpern

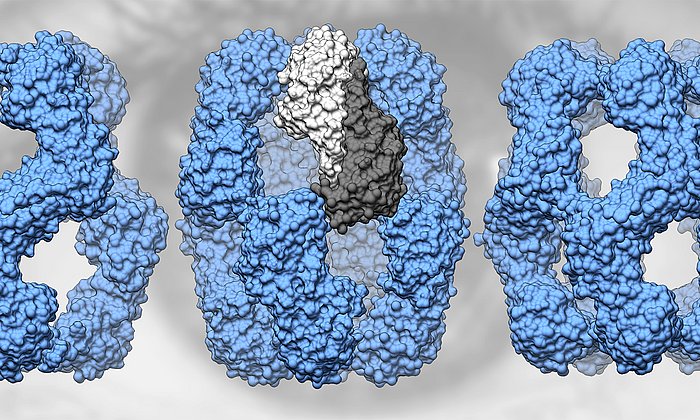
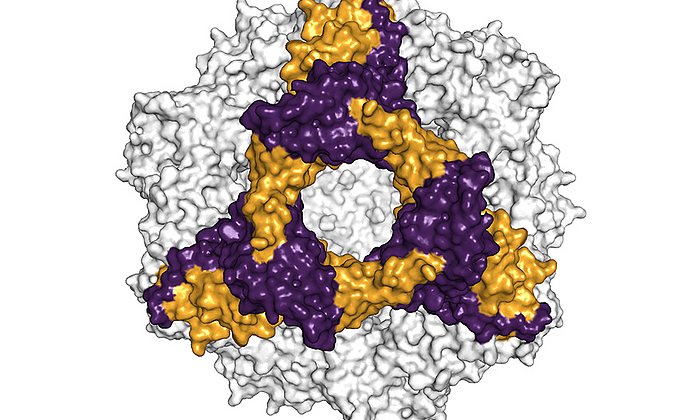
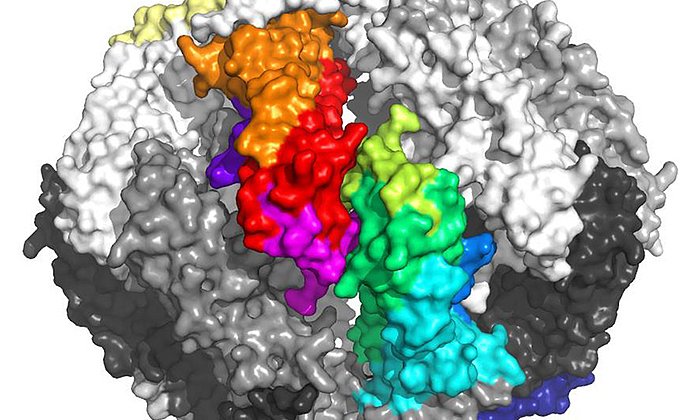
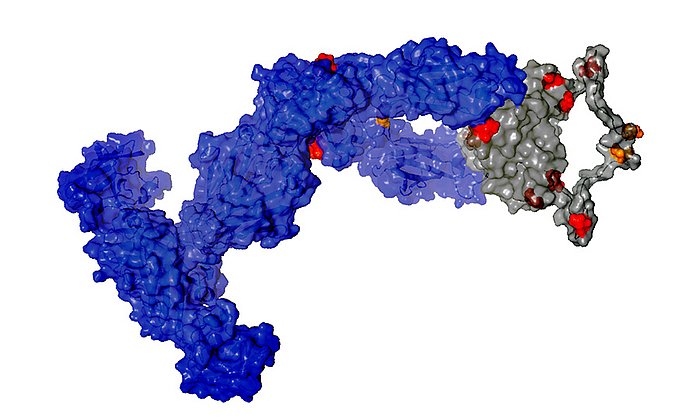
Antikörper sind überlebenswichtig für den menschlichen Organismus. Typischerweise bestehen sie aus zwei längeren und damit schwereren sowie zwei leichteren Aminosäureketten. In seltenen Fällen vermehren sich die Plasmazellen übermäßig und überschwemmen den Körper mit den leichten Antikörperketten.
Erkrankt ein Mensch an Leichtketten-Amyloidose (AL-Amyloidose), lagern sich diese leichten Ketten dann in Form feinster Fasern, sogenannten Amyloid-Fibrillen, in Gewebe oder in Organen ab. Oft wird die Erkrankung erst erkannt, wenn die Ablagerungen die Funktion der Organe spürbar einschränken. Meist endet sie tödlich.
„Bisher war über die genaue Ursache dieser Amyloidose wenig bekannt“, sagt Johannes Buchner, Professor für Biotechnologie an der TU München. „Je nachdem, welches Organ betroffen ist, variieren die Symptome erheblich. Außerdem produziert jeder Patient unterschiedliche Varianten von Antikörpern. Die Krankheit ist daher im frühen Stadium nur schwer zu diagnostizieren.“
Eine Mutation löst die tödliche Krankheit aus
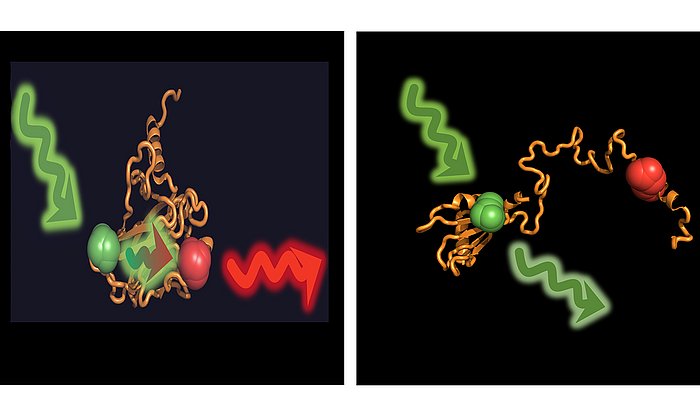
Mit verschiedenen analytischen und datenbankgestützten Verfahren gelang es dem Wissenschaftsteam, elf Mutationen im krankheitsbedingt veränderten Antikörper einer Patientin mit fortgeschrittener AL-Amyloidose zu identifizieren.
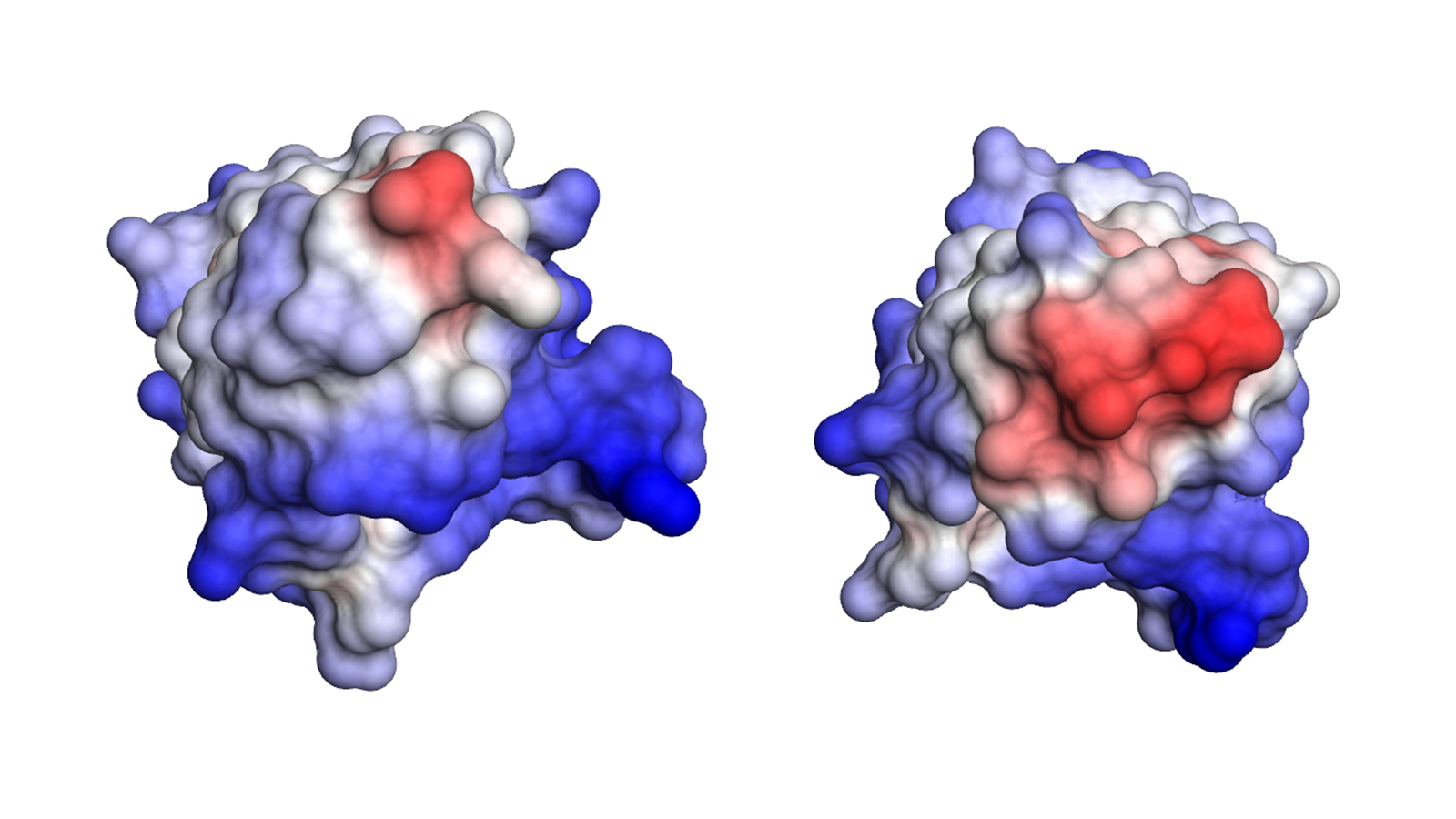
Weitere Untersuchungen zeigten, dass genau eine Mutation für die Bildung der krankmachenden Amyloid-Fibrillen verantwortlich war. Diese Mutation hat zur Folge, dass die instabile leichte Kette nach dem Bruch in zwei Proteinfragmente ihre Struktur verliert, was dann die Bildung der tödlichen Amyloid-Fibrillen auslöst.
„Unsere Untersuchung zeigt, dass Mutationen, die zu instabilen leichten Ketten führen, einen wesentlichen Faktor für das Auftreten einer Amyloidose darstellen“, sagt Pamina Kazman, die den Großteil der Messungen durchgeführt hat. „Langfristig hoffen wir, dass diese und weitere Untersuchungen zu neuen, früher greifenden Diagnosemethoden und eventuell sogar zu neuen Behandlungsmöglichkeiten führen.“
Fatal amyloid formation in a patient’s antibody light chain is caused by a single point mutation
Pamina Kazman, Marie-Theres Vielberg, María Daniela Pulido Cendales, Lioba Hunziger, Benedikt Weber, Ute Hegenbart, Martin Zacharias, Rolf Köhler, Stefan Schönland, Michael Groll, Johannes Buchner
eLife, online: 10.03.2020
Die Forschungsarbeit wurde unterstützt mit Mitteln der Deutschen Forschungsgemeinschaft (DFG). Die Proteinstrukturen wurden an den Synchrotron-Strahlungsquellen des Paul Scherrer Instituts in Villigen (Schweiz) und der Europäischen Synchrotron-Strahlungsquelle in Grenoble (Frankreich) bestimmt.
Bilder in hoher Auflösung
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Dr. Johannes Buchner
Lehrstuhl für Biotechnologie
Technische Universität München
Lichtenbergstraße 4, 85748 Garching, Germany
Tel.: +49 89 289 13340 – johannes.buchner@tum.de