Big-Data-Studie identifiziert Ursache für Atemwegserkrankungen bei Rindern
Genmutation führt zu frühem Tod von Kälbern
Atemwegserkrankungen zählen zu den häufigsten Krankheiten von Kälbern. Dem Team um Hubert Pausch vom Lehrstuhl für Tierzucht von der Technischen Universität München ist es gelungen sowohl beim Braunvieh als auch beim Fleckvieh eine verantwortliche Genmutation aufzuspüren: In reinerbigem Zustand (homozygot) verändert sie den Aufbau der Flimmerhärchen der Atemwege. Das bedeutet, dass beide Elternteile Träger der Genmutation waren.
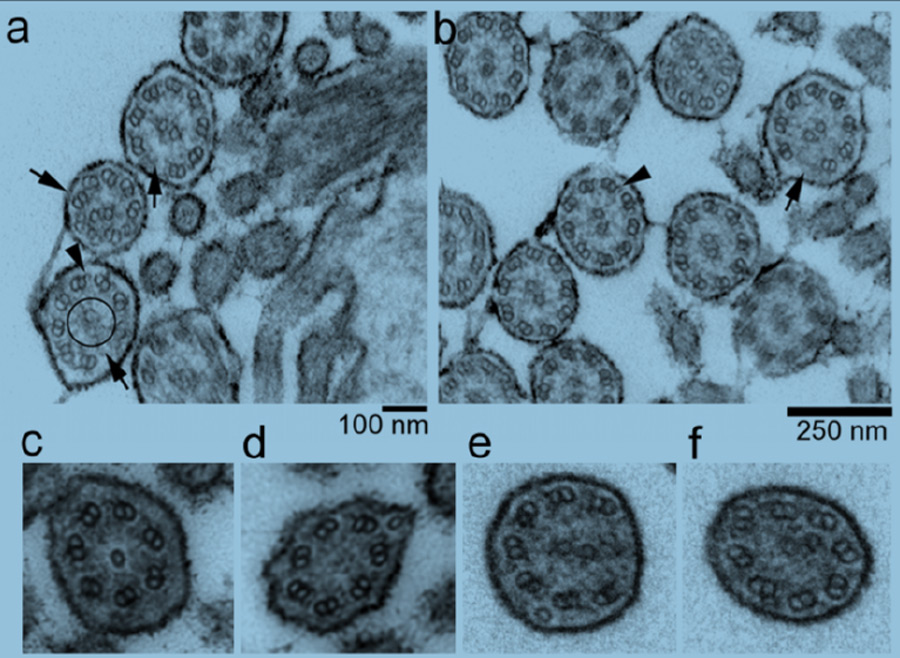
Der veränderte Aufbau beeinträchtigt die Bewegung der Flimmerhärchen und so können sie die Atemwege nicht mehr genügend von Sekret befreien. Die mangelnde Reinigung führt zu chronischen Infektionen. Defekte Flimmerhärchen verursachen auch beim Menschen eine Erkrankung der Atemwege, die allerdings sehr seltene auftritt.
An der Studie, veröffentlicht in der Fachzeitschrift BMC Genomics, beteiligten sich neben dem TUM-Lehrstuhl für Tierzucht auch Wissenschaftler der Zentralen Arbeitsgemeinschaft österreichischer Rinderzüchter, des Kompetenzzentrums für Informatik & Genetik für Schweizer Zuchtorganisationen und der Rinderkliniken der Wiener und Züricher Universitäten.
Gesunde Kälber sind für eine erfolgreiche und nachhaltige Rinderzucht entscheidend. Die dominierenden Rinderrassen in Süddeutschland, Österreich und der Schweiz sind Fleckvieh und Braunvieh. Fleckvieh liefert Milch und Fleisch in hoher Quantität und Qualität, Braunvieh liefert vor allem Milch. In beiden Rassen werden züchterisch interessante Tiere über das komplette Genom hinweg genotypisiert, das bedeutet der genetische Fingerabdruck wird genommen, um ihre Erbanlagen zu erfassen. Auf diese Weise offenbaren sich individuelle Veränderungen, die zeigen, welche Anlagen ein Tier vererbt – sowohl positive als auch negative wie etwa genetisch-bedingte Krankheiten.
Bisher umfangreichste Daten-Analyse beim Rind
Die Veränderung auf Chromsom 19 wurde beim Braunvieh bereits vor einigen Jahren entdeckt. Jetzt wurde sie auch beim Fleckvieh vorgefunden. „Es ist nun erstmals der Nachweis gelungen, dass die Genmutation wahrscheinlich bereits vor der Aufspaltung in die Rassen Braun- und Fleckvieh entstanden ist“, sagt Wissenschaftler Pausch. Das von ihm koordinierte Team untersuchte die Genom-Sequenzen von 290 ausgewählten Tieren und damit mehrere tausend Gigabyte Daten.
Bei der Durchsicht der Genom-Datenbanken der Rinderzuchtverbände fiel dem Team von Pausch auf, dass die Mutation nahezu nie reinerbig zu finden war. „Wenn sowohl der Vater als auch die Mutter Träger der schadhaften Genvariante waren, war die Überlebenswahrscheinlichkeit der Nachkommen deutlich geringer. Reinerbige Nachkommen sind kurz nach der Geburt verendet und wurden somit auch nicht in die Genom-Datenbank aufgenommen.“
Schwierige Suche nach erkrankten Kälbern
Um dennoch die Ursache für die hohe Kälbersterblichkeit aufzuklären, mussten die Wissenschaftler aber gerade die in den Datenbanken fehlenden reinerbigen Kälber untersuchen. Dafür galt es, die reinerbigen Tiere rechtzeitig, also unmittelbar nach der Geburt aufzuspüren und klinisch zu charakterisieren. „Diese zu finden, war nicht einfach“, erinnert sich Pausch. Zwölf reinerbige Kälber konnten die Wissenschaftler letztlich ausfindig machen: Fünf wurden tot geboren, drei starben innerhalb von 30 Tagen und vier konnten an die Rinderkliniken nach Wien und Zürich gebracht werden.
Diese vier Kälber waren deutlich untergewichtig und litten an wiederkehrenden Atemwegserkrankungen. Aufgrund der kontinuierlichen Verschlechterung ihres Gesundheitszustandes mussten die Tiere nach wenigen Wochen eingeschläfert werden. Die pathologischen Untersuchungen zeigten Veränderungen am Aufbau der Flimmerhärchen in den Atemwegen.
Radikale Konsequenzen der Studie in der Rinderzucht
Seit die Ergebnisse der Studie bekannt sind, schließen die Zuchtverbände Träger-Tiere dieser Mutation von der Zucht aus. Hubert Pausch hält diese Entscheidung für „sehr radikal“ und mittelfristig nicht praktikabel. Er gibt zu bedenken: „Jedes Individuum trägt schadhafte Gene in sich.“ Für Pausch ist die Strategie der Zuchtverbände aber auch nachvollziehbar: „Ein Zuchtstier mit sehr guten Erbanlagen hat zwischen 10.000 und 100.000 Nachkommen und rezessive Varianten wie etwa die Mutation auf Chromosom 19 können sich so rasch in der Population anreichern.“
Pausch hält es für wesentlich ratsamer, eine Verpaarung mit Kühen zu vermeiden, die ebenfalls die Genmutation in sich tragen. Denn ein nicht reinerbiges (heterozygotes) Kalb, das nur eine Variante des schadhaften Gens in sich trägt, erkrankt nicht. Momentan werden weibliche Tiere allerdings nicht genotypisiert. Der TUM-Wissenschaftler erwartet hier aber eine baldige Änderung der bisherigen Erfassung.
Sobald auch weibliche Tiere flächendeckend genotypisiert sind, kann über genombasierte Anpaarungsstrategien verhindert werden, dass Anlageträger verpaart werden. So ließen sich züchterisch interessante Mutationsträger weiterhin einsetzen, ohne dass reinerbige Nachkommen mit wiederkehrenden Atemwegserkrankungen geboren werden.
Publikation:
Hermann Schwarzenbacher, Johann Burgstaller, Franz R. Seefried, Christine Wurmser, Monika Hilbe, Simone Jung, Christian Fuerst, Nora Dinhopl, Herbert Weissenböck, Birgit Fuerst-Waltl, Marlies Dolezal, Reinhard Winkler, Oskar Grueter, Ulrich Bleul, Thomas Wittek, Ruedi Fries, Hubert Pausch: A missense mutation in TUBD1 is associated with high juvenile mortality in Braunvieh and Fleckvieh cattle, BMC genomics 2016.
DOI: 10.1186/s12864-016-2742-y
Kontakt:
Dr. Hubert Pausch (Kontakt via Mail, da Post-Doc in Melbourne)
Technische Universität Muenchen
Lehrstuhl fuer Tierzucht
Liesel-Beckmann-Straße 1
D-85354 Freising-Weihenstephan
E-Mail: hubert.pausch@tierzucht.tum.de
Professor Ruedi Fries
Lehrstuhl für Tierzucht
Technische Universität München
Liesel-Beckmann-Str. 1
85354 Freising
E-Mail: ruedi.fries@tum.de
Tel: +49 8161 713228
Technische Universität München
Corporate Communications Center
- Sabine Letz
- letz@zv.tum.de
- presse@tum.de
- Teamwebsite