Hohlkörper aus DNA-Material könnten Viren einfangen und unschädlich machen
Die Viren-Falle

Gegen gefährliche Bakterien gibt es Antibiotika – gegen die meisten Virus-Infektionen gibt es leider bisher keine direkt wirksamen Gegenmittel. Manchen Infektionen kann man durch Impfungen vorbeugen, einen solchen Impfstoff zu entwickeln, ist jedoch aufwändig.
Eine völlig neue Strategie für die Therapie akuter Vireninfektionen schlägt nun ein interdisziplinäres Forschungsteam der Technischen Universität München, des Helmholtz Zentrums München und der Brandeis University (USA) vor. Das Team hat Nanostrukturen aus DNA entwickelt, dem Material, aus dem unser Erbgut besteht, die Viren einfangen und unschädlich machen können.
Nanostrukturen aus DNA
Schon bevor die neue Variante des Corona-Virus begann die Welt in Atem zu halten, arbeiteten Hendrik Dietz, Professor für Biomolekulare Nanotechnologie am Physik-Department der TU München, und sein Team an der Konstruktion von Objekten in Virusgröße, die sich selbst zusammensetzen.
1962 hatten der Biologe Donald Caspar und der Biophysiker Aaron Klug herausgefunden, nach welchen geometrischen Gesetzmäßigkeiten die Proteinhüllen von Viren aufgebaut sind. Ausgehend von diesen geometrischen Vorgaben entwickelte das Team um Hendrik Dietz an der TU München, unterstützt durch Seth Fraden und Michael Hagan von der Brandeis University in den USA, ein Konzept, mit dem es gelang, künstliche Hohlkörper in Virengröße zu produzieren.
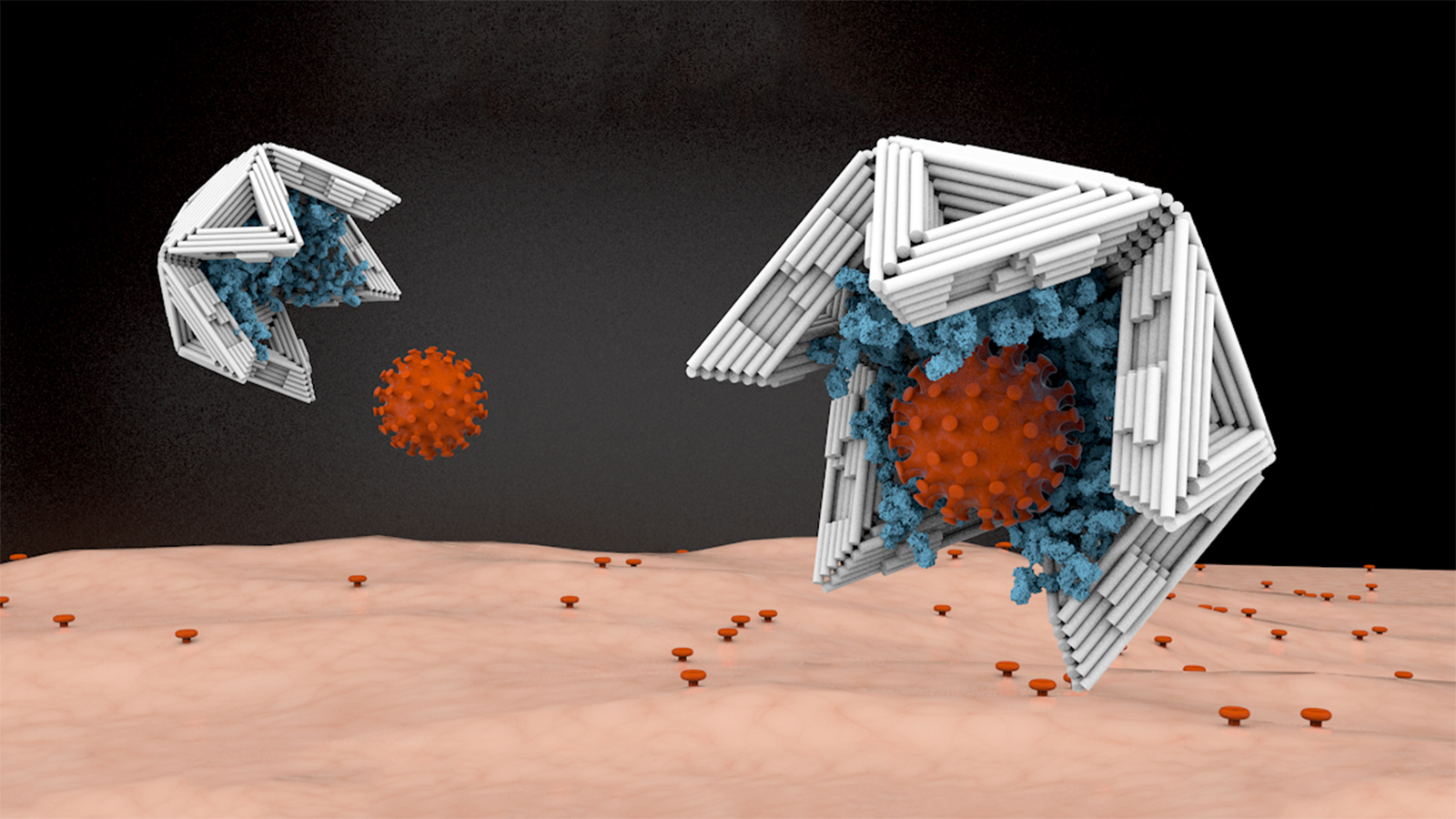
Im Sommer 2019 kam im Team die Frage auf, ob solche Hohlkörper auch als eine Art „Virenfalle“ verwendet werden könnten. Würde man sie innen mit Virus-bindenden Molekülen auskleiden, müssten sie Viren fest an sich binden und damit aus dem Verkehr ziehen können. Dafür müssten die Hohlkörper aber auch ausreichend große Öffnungen aufweisen durch die Viren in die Schalen gelangen können.
„Keines der Objekte, die wir bis dato mit der Technologie des DNA-Origami gebaut hatten, wäre in der Lage gewesen, ein ganzes Virus sicher einschließen zu können – sie waren schlicht zu klein“, sagt Hendrik Dietz rückblickend. „Stabile Hohlkörper von dieser Größe zu bauen, war eine riesige Herausforderung.“
Der Baukasten für eine Virusfalle
Ausgehend von der grundlegenden geometrischen Form des Ikosaeders, einem Objekt, das sich aus 20 Dreiecksflächen aufbaut, entschied sich das Team dazu, die Hohlkörper für die Virenfalle aus dreidimensionalen, dreieckigen Platten aufzubauen.
Damit die DNA-Platten sich zu größeren geometrischen Gebilden zusammensetzen können, müssen die Kanten etwas abgeschrägt sein. Die richtige Wahl und Positionierung von Bindungsstellen auf den Kanten sorgen dann dafür, dass die Platten sich von selbst zu den gewünschten Objekten zusammensetzen.
„Auf diese Weise können wir nun Form und Größe der gewünschten Objekte durch die exakte Form der Dreiecksplatten programmieren“, sagt Hendrik Dietz. „Inzwischen können wir Objekte mit bis zu 180 Untereinheiten erzeugen und erreichen Ausbeuten von bis zu 95 Prozent. Der Weg dahin war allerdings recht steinig, mit vielen Iterationen.“
Viren werden zuverlässig blockiert
Indem sie die Bindungsstellen an den Kanten der Dreiecke variieren, können die Wissenschaftlerinnen und Wissenschaftler des Teams nicht nur geschlossene Hohlkugeln, sondern auch Kugeln mit Öffnungen oder Halbschalen erzeugen. Diese können dann als Virenfallen verwendet werden.
In Kooperation mit dem Team von Prof. Ulrike Protzer, Leiterin des Instituts für Virologie der TUM und Direktorin des Instituts für Virologie am Helmholtz-Zentrum München, testete das Team die Virusfallen an Adeno-assoziierten Viren und Hepatitis-B-Virus-Kernen.
„Schon eine einfache Halbschale passender Größe zeigt eine messbare Reduzierung der Aktivität der Viren“, sagt Hendrik Dietz. „Bringen wir auf der Innenseite fünf Bindungsstellen für das Virus an, beispielsweise passende Antikörper, erreichen wir bereits eine Blockierung des Virus von 80 Prozent, bauen wir mehr ein, erreichen wir eine komplette Blockade.“
Damit die DNA-Partikel in Körperflüssigkeiten nicht sofort abgebaut werden, bestrahlte das Team die fertigen Bausteine mit UV-Licht und behandelte sie äußerlich mit Polyethylenglykol und Oligolysin. Damit waren die Partikel in Mäuseserum über 24 Stunden stabil.
Ein universelles Bauprinzip
Als Nächstes müssen die Bausteine nun an lebenden Mäusen getestet werden. „Wir sind sehr zuversichtlich, dass dieses Material auch vom menschlichen Körper gut vertragen wird“, sagt Dietz.
„Bakterien haben einen Stoffwechsel. Da können wir sie auf verschiedenen Wegen angreifen“, sagt Prof. Ulrike Protzer. „Viren haben dagegen keinen eigenen Stoffwechsel, antivirale Medikamente richten sich daher fast immer gezielt gegen ein bestimmtes Enzym eines einzelnen Virus. Eine solche Entwicklung kostet Zeit. Sollte sich die Idee realisieren lassen, Viren einfach mechanisch zu eliminieren, so wäre das breit anwendbar und damit ein wichtiger Durchbruch insbesondere für neu auftretende Viren.“
Die Ausgangsmaterialien der Virusfallen lassen sich biotechnologisch in Massenproduktion zu vertretbaren Kosten herstellen. „Neben der vorgeschlagenen Anwendung als Virusfalle bietet unser programmierbares System auch noch weitere Möglichkeiten“, sagt Hendrik Dietz. „Denkbar wäre es auch als multivalenter Antigenträger für Impfungen, als DNA- oder RNA-Träger für die Gentherapie oder als Transportvehikel für Arzneimittel einzusetzen.“
Christian Sigl, Elena M. Willner, Wouter Engelen, Jessica A. Kretzmann, Ken Sachenbacher, Anna Liedl, Fenna Kolbe, Florian Wilsch, S. Ali Aghvami, Ulrike Protzer, Michael F. Hagan, Seth Fraden and Hendrik Dietz
Programmable icosahedral shell system for virus trapping
Nature Materials, 14. Juni 2021 – DOI: 10.1038/s41563-021-01020-4
Diese Arbeit wurde gefördert mit Mitteln des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Gemeinschaft im Rahmen des FET-Open Projekts VIROFIGHT (Grant Nr. 899619), des European Research Council (ERC) im Rahmen eines Consolidator Grant, der Deutschen Forschungsgemeinschaft (DFG) über den SFB863 und den TRR179 sowie durch Fördermittel im Rahmen des Gottfried-Wilhelm-Leibniz-Programms, des Bundesministeriums für Bildung und Forschung (BMBF) über das Projekt StabVacB und das Deutsche Zentrum für Infektionsforschung (DZIF), der Niederländischen Organisation für wissenschaftliche Forschung (NWO), der National Science Foundation der USA durch das Brandeis University Materials Research Science and Engineering Center, des National Institute of General Medical Sciences (NIGMS) der USA und der Alexander von Humboldt-Stiftung (AvH).
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Dr. Hendrik Dietz
Professur für Biomolekulare Nanotechnologie
Technische Universität München
Am Coulombwall 4a, 85748 Garching
Tel.: +49 89 289 11615
E-Mail: dietz@tum.de