Neue Strategie verspricht Erfolg auch gegen zukünftige SARS-CoV-2-Varianten
Ein Medikament gegen Covid-19

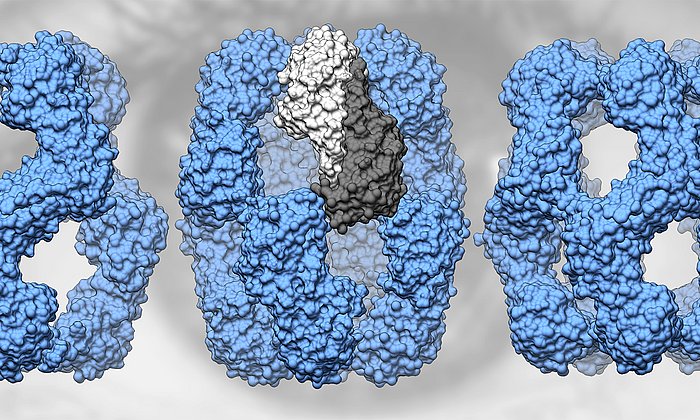
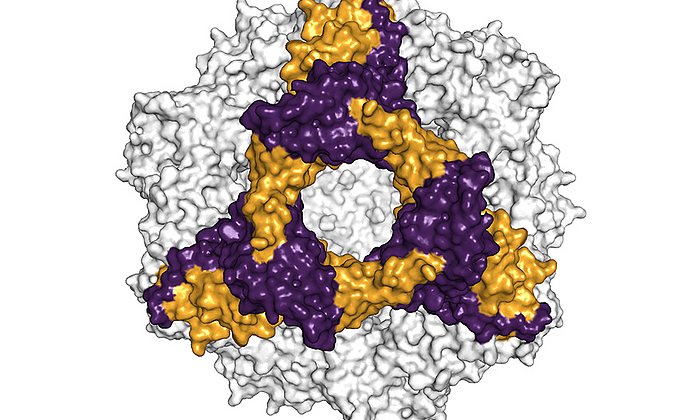
Das SARS-CoV-2-Virus nutzt ein Protein an der Oberfläche menschlicher Zellen als Eintrittspforte, das sogenannte Angiotensin-converting enzyme 2 (ACE2). Hier greift das sogenannte Spike-Protein des Virus an, um anschließend die Zelle zu infizieren. Die bisher wirksamste medikamentöse Therapie, die wir gegen das SARS-CoV-2 in der Hand haben, sind Antikörper-Therapien.
Hierbei werden rekombinante Antikörper zur Therapie von Covid-19-Erkrankungen eingesetzt, unter anderem auch am TUM-Klinikum rechts der Isar, jedoch entzieht das Virus, sich durch Mutation dem Angriff durch die therapeutischen Antikörper und teilweise sogar den natürlichen, nach einer Impfung ausgebildeten Antikörpern.
Körpereigene Proteine im Einsatz gegen das Virus
Eine andere Strategie verfolgt ein Team aus Wissenschaftlerinnen und Wissenschaftlern der Technischen Universität München, der Ludwig-Maximilians-Universität München, von Helmholtz Munich und der Münchener Formycon AG: Sie haben das ACE2-Protein mit einem Teil eines menschlichen Antikörper-Proteins verbunden und damit einen Wirkstoff geschaffen, der das Spike-Protein des Virus blockiert. In Zellkulturversuchen konnten sie damit das Virus komplett neutralisieren und eine Infektion verhindern.
„Sowohl Impfstoffe als auch Antikörper-Medikamente haben das Problem, dass das Virus ihnen mit jeder erfolgreichen Mutation ein klein wenig ausweicht“, sagt Ulrike Protzer, Leiterin des Instituts für Virologie der TU München und bei Helmholtz Munich. „Dadurch entstehen sogenannte Immune-Escape Varianten.“
Das Team um Professorin Ulrike Protzer und Johannes Buchner, Professor für Biotechnologie in der Chemie-Fakultät der TU München in Garching, bietet daher dem Virus sein wichtigstes Ziel an, das ACE2-Protein.
Die optimale Strategie gegen Mutationen
Da das einfache ACE2-Protein von anderen Enzymen im menschlichen Körper zu schnell abgebaut würde, fusionierten sie das ACE2-Protein mit einem Fragment des menschlichen Antikörpers Immunglobulin G (IgG).
„Da ein optimales Andocken an das ACE2-Protein für das Virus überlebensnotwendig ist, kann das Virus einem Medikament, das genau auf diesem Protein basiert, nicht ausweichen“, sagt Prof. Buchner. „Das Fusionsprotein wird daher auch gegen zukünftige Mutationen sicher wirken.“
Laborversuche mit dem Fusionsprotein, das intern den Namen FYB207 bekommen hat, dem ursprünglichen Virus und den Varianten Alpha, Beta und Delta bestätigen die Annahme des Forschungsteams. Versuche der neuen Omikron-Variante starten gerade.
Zusätzlicher Schutz durch das ACE2-Protein
FYB207 kann potenziell gegen allen Corona-Viren eingesetzt werden, die ACE2 als Eintrittspforte benutzen – nicht nur gegen Varianten des aktuellen SARS-CoV-2-Virus. ACE2 besitzt darüber hinaus eine natürliche Enzymaktivität im Herz-Kreislaufsystem, die einen zusätzlichen Schutz für Lunge, Herz und Niere vor einem bedrohlichen Organversagen bieten könnte.
Zu Beginn der Forschungsarbeit wurden verschiedene Kombinationen von ACE2 und Immunglobulin-Fragmente als Fusionsproteine im Labor getestet. Das Team entschied sich für ein stabiles Fragment des IgG4-Proteins als Fusionspartner. Um die Stabilität weiter zu erhöhen, wurden geringfügige Mutationen eingebaut. Zwei Varianten werden derzeit in präklinischen Studien eingehend untersucht.
„Das Fusionsprotein lässt sich gut biotechnologisch herstellen“, sagt Dr. Carsten Brockmeyer, Mitautor der Studie und CEO der Formycon AG. „Im Rahmen der Kooperation haben wir auch darauf geachtet, dass die ausgewählten Wirkstoffvariationen pharmakologisch günstige Eigenschaften haben. Im ersten Halbjahr des kommenden Jahres hoffen wir, mit den ersten klinischen Studien beginnen zu können.“
„Das SARS-CoV-2-Virus und seine Verwandten werden die Menschheit auch in Zukunft weiter begleiten“, sagt Prof. Ulrike Protzer. „Auch wenn die Impfung schwere Krankheitsverläufe sehr zuverlässig verhindert, die deutlich ansteckenderen Delta- und Omikron-Varianten haben gezeigt, dass sich sowohl Genesene als auch Geimpfte erneut anstecken können. Vor dem Hintergrund zukünftiger, möglicherweise noch ansteckenderer Varianten brauchen wir daher neben der Impfung auch einen breit wirksamen Wirkstoff gegen dieses Virus.“
Picomolar inhibition of SARS-CoV-2 variants of concern by an engineered ACE2-IgG4-Fc fusion protein
Hristo L. Svilenov, Julia Sacherl, Alwin Reiter, Lisa S. Wolff, Cho-Chin Cheng, Marcel Stern, Vincent Grass, Martin Feuerherd, Frank-Peter Wachs, Nicole Simonavicius, Susanne Pippig, Florian Wolschin, Oliver T. Keppler, Johannes Buchner, Carsten Brockmeyer und Ulrike Protzer
Antiviral Research 196 (2021) 105197 – DOI: 10.1016/j.antiviral.2021.105197
Die Arbeiten wurden gefördert durch die Bayerische Forschungsstiftung, das FOR-COVID-Netzwerk des Bayerischen Staatsministeriums für Wissenschaft und Kunst, die Helmholtz Gemeinschaft und die Peter und Traudl Engelhorn-Stiftung.
Die Entwicklung befindet sich derzeit in der präklinischen Phase. Eine Teilnahme an klinischen Studien ist zum gegenwärtigen Zeitpunkt nicht möglich.
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Dr. med. Ulrike Protzer
Institut für Virologie
Technische Universität München
Trogerstr. 30, 81675 München
Tel.: +49 89 4140 6821
E-Mail: protzer@tum.de
Prof. Dr. Johannes Buchner
Lehrstuhl für Biotechnologie
Technische Universität München
Lichtenbergstraße 4, 85748 Garching
Tel.: +49 89 289 13340
E-Mail: johannes.buchner@tum.de