Bildung und Reparatur der Myelinschicht um Nervenfasern erstmals „live“ untersucht
Myelin-Muster unter Beobachtung
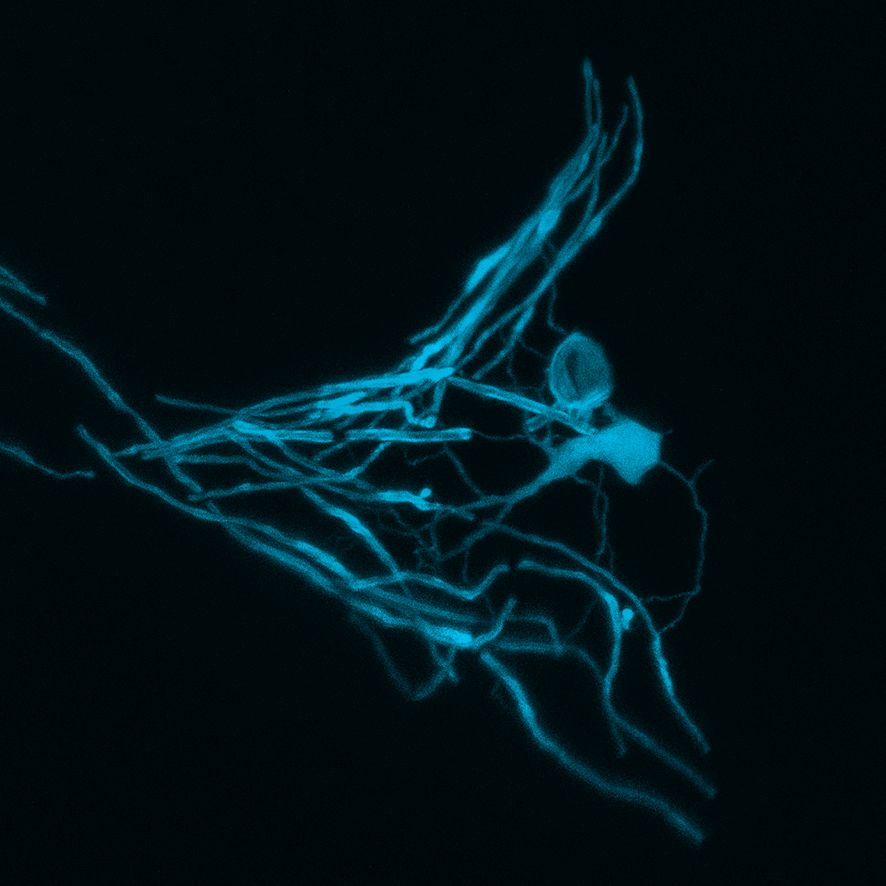
Die Myelinhülle um Fortsätze von Nervenzellen (Axone) lässt sich mit der Isolation um elektrische Kabel vergleichen. Myelin schirmt das Axon ab und macht eine schnelle Übertragung von elektrischen Signalen erst möglich. Wird die Isolierung beschädigt, beispielsweise bei Erkrankungen wie Multipler Sklerose, kann es zu schweren Ausfallerscheinungen kommen.
Myelinsegmente bestimmen Übertragungsgeschwindigkeit
Das Myelin bildet allerdings keinen durchgängigen Schlauch um das Axon, sondern ist in Segmente unterteilt. Diese können unterschiedlich lang sein und sind jeweils durch sogenannte Ranviersche Schnürringe voneinander getrennt. Im komplexen Netzwerk des Zentralnervensystems geht es nicht darum, alle Verbindungen so schnell wie möglich zu machen. Entscheidend ist vielmehr das Feintuning: Impulse müssen zum exakt richtigen Zeitpunkt am richtigen Ort sein. Wie schnell Informationen durch ein Axon übertragen werden, wird auch durch die Zahl und Länge der Segmente beeinflusst.
Muster bleiben stabil
Der Körper von Menschen und Tieren ist zumindest teilweise in der Lage, beschädigte Myelinhüllen zu reparieren. Dr. Tim Czopka, Neurowissenschaftler an der TUM, hat diesen Prozess erstmals „live“ beobachtet. Durch eigens entwickelte Markierungssubstanzen konnten er und sein Team sichtbar machen, wie Myelinsegmente um Axone im Rückenmark von Zebrafischen gebildet werden. Dabei stellten sie fest: Charakteristische Muster mit unterschiedlich langen Myelinsegmenten entlang eines Axons werden innerhalb weniger Tage nach dem Beginn der Myelinbildung festgelegt. Danach wachsen die Segmente zwar weiterhin – schließlich wächst auch der Körper des Fisches – das Muster bleibt aber erhalten.
In einem nächsten Schritt zerstörten Tim Czopka und sein Team gezielt einzelne Segmente. „Dabei erlebten wir eine Überraschung“, sagt Czopka. „Nach der Zerstörung begann die Myelinschicht, sich dynamisch zu verändern. Am Ende war der Schaden repariert und das ursprüngliche Muster in den meisten Fällen wieder hergestellt.“ Der Wiederaufbau folgte einem festen Schema: Zunächst dehnten sich die benachbarte Segmente aus, wie um die Lücke zu schließen. Dann wuchs zwischen ihnen ein neues Segment und sie schrumpften wieder auf ihre ursprüngliche Größe zurück.
Axone beeinflussen Segmentbildung
Daraus ergibt sich eine wichtige Frage: Wer steuert Entstehung und Wiederherstellung des Segmentmusters? „Unsere Beobachtungen legen nahe, dass nicht die myelinbildenden Zellen, die Oligodendrozyten, sondern die Axone bestimmen, wo Myelin gebildet wird“, sagt Tim Czopka. „Man könnte sagen, dass sie am besten wissen, welches Muster für die ideale Übertragungsgeschwindigkeit benötigt wird.“
Derzeit erforschen er und sein Team, wie sich die Segmentmuster durch gezielt ausgelöste Nervenzellaktivität und dabei ausgeschüttete Botenstoffe verändern. „Wenn wir die Rolle der Axone bei der Myelinregeneration verstehen, könnten sich neue Ansätze ergeben, um sie zu steuern“, erläutert Czopka. „Das wäre beispielsweise für die Behandlung von Erkrankungen wie Multipler Sklerose relevant.“
Publikation:
F. Auer, S. Vagionitis, T. Czopka, “Evidence for Myelin Sheath Remodeling in the CNS Revealed by In Vivo Imaging”, Current Biology (2018). DOI: 10.1016/j.cub.2018.01.017. (Open Access)
Kontakt:
Dr. Tim Czopka
Technische Universität München
Institut für Zellbiologie des Nervensystems
Tel: +49 89 4140-3377
tim.czopka@tum.de
Mehr Informationen:
Dr. Tim Czopka leitet eine Emmy-Noether-Nachwuchsforschungsgruppe am Institut für Zellbiologie des Nervensystems der TUM. Das aktuelle Forschungsprojekt wurde von der Deutschen Forschungsgemeinschaft (DFG) finanziert. Seit 2016 fördert der Europäische Forschungsrat (ERC) Czopkas Forschung mit einem ERC Starting Grant. Tim Czopka ist Mitglied des Exzellenzclusters für Systemneurologie, SyNergy.
Technische Universität München
Corporate Communications Center
- Paul Hellmich
- paul.hellmich@tum.de
- presse@tum.de
- Teamwebsite


