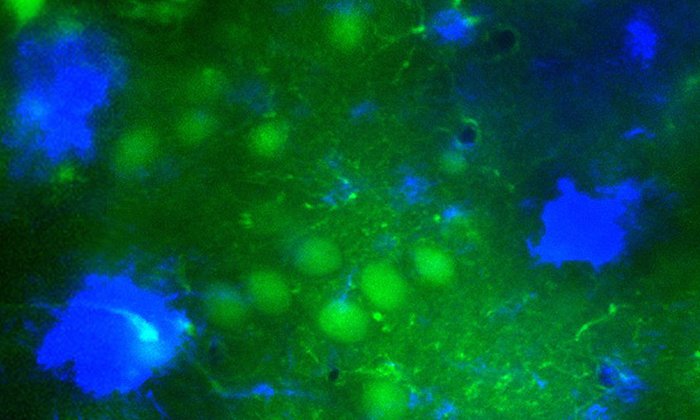
Amyloidplaques bei Alzheimer und Diabetes: Neue Leitstrukturen für Hemmstoffe
Moleküle können Proteinaggregation unterdrücken
Die Wissenschaftler haben 16 verschiedene peptidische Moleküle entworfen und untersucht, welche von ihnen die Verklumpung der mit Alzheimer- oder Diabetes Typ 2 assoziierten Proteine Amyloid-ß (Aß) und Insel-Amyloidpolypeptid (IAPP) verhindern. Die Moleküle wurden auf der Basis von wissenschaftlichen Arbeiten entworfen, die belegen, dass die beiden Proteine Aß und IAPP miteinander wechselwirken, und dass diese „Kreuzamyloid-Wechselwirkung“ die Verklumpung beider Proteine unterdrückt.
Die Forscher haben für ihre Entwürfe spezielle kurze Sequenzregionen von IAPP gewählt, die den Kernregionen der Wechselwirkung mit dem Alzheimer-Protein entsprechen. Diese sogenannten „Hot-Spot-Segmente“, wurden dann miteinander durch spezielle Peptidsegmente chemisch verknüpft mit dem Ziel die IAPP-Kreuzamyloid-Wechselwirkungsfläche nachzuahmen und zu optimieren.
Hemmstoffe verhindern gefährliche Plaquebildung, die Alzheimer und Diabetes begünstigen
Das Team um Aphrodite Kapurniotu, Professur für Peptidbiochemie am Wissenschaftszentrum Weihenstephan konnte in Zusammenarbeit mit Forschern um Bernd Reif, Professur für Festkörper-NMR-Spektroskopie der TU München und Professor Gerhard Rammes aus der Anesthesiologie am Klinikum rechts der Isar bei seinen Entwürfen hochpotente Inhibitoren des Protein-Verklumpungsmechanismus identifizieren: Drei der Peptid-Designentwürfe verhinderten die zytotoxische Verklumpung beim Alzheimer- und Diabetes Typ 2-Peptid zugleich. Vier weitere wiederum hemmten lediglich selektiv die Selbstassoziation von Aß und eines bremste selektiv die Verklumpung bei IAPP.
Die Ergebnisse zeigen eine neuartige Klasse von Peptidleitstrukturen auf, die die Fehlfaltung und Verklumpung pathologisch relevanter Amyloidproteine bei Alzheimer und beim Typ 2 Diabetes hemmen. Deshalb könnten sie sich prinzipiell zur Entwicklung von Therapeutika eignen. Denkbar ist auch, dass mit dem entwickelten Inhibitorkonzept Moleküle, die die krankheitsassoziierten Wechselwirkungen anderer Proteine hemmen, entworfen werden können.
Über Ihre Ergebnisse berichten die Forscher in der Fachzeitschrift Angewandte Chemie. Weitere Studien sind nun in Vorbereitung, um einerseits die Ergebnisse aus dem Reagenzglas weiter in Richtung medizinischer Anwendung voranzutreiben und andererseits die Übertragung des Inhibitorprinzips auf andere Proteine zu überprüfen.
Publikation:
Erika Andreetto, Eleni Malideli, Li-Mei Yan, Michael Kracklauer, Karine Farbiarz,Marianna Tatarek-Nossol, Gerhard Rammes, Elke Prade, Tatjana Neumüller, Andrea Caporale, Anna Spanopoulou, Maria Bakou, Bernd Reif, and Aphrodite Kapurniotu: A Hot-Segment-Based Approach for the Design of Cross-Amyloid Interaction Surface Mimics as Inhibitors of Amyloid Self-Assembly, Angewandte Chemie 2015.
DOI: 10.1002/anie.201504973
Kontakt:
Prof. Dr. Aphrodite Kapurniotu
Technische Universität München
Professur für Peptidbiochemie
Tel: 0049-8161-713542
E-Mail: akapurniotu@wzw.tum.de
Technische Universität München
Corporate Communications Center
- Sabine Letz
- sabine.letz@tum.de
- presse@tum.de
- Teamwebsite