Nanopartikel mit synthetischer DNS können Wirkstoffe kontrolliert freisetzen
Gezielte Medikamentenlieferung in die Zelle

Unser Körper ist aus Milliarden von Zellen aufgebaut. Bei einer Krebserkrankung ist das Genom einiger dieser Zellen krankhaft verändert, sodass diese sich unkontrolliert teilen. Auch bei Virusinfektionen befindet sich die Ursache der Erkrankung in den betroffenen Zellen. Mithilfe von Medikamenten wird etwa während einer Chemotherapie versucht, diese Zellen zu zerstören. Allerdings wirkt die Therapie auf den gesamten Körper, auch gesunde Zellen werden geschädigt, und es kommt zu teils heftigen Nebenwirkungen.
Ein Forschungsteam um Prof. Oliver Lieleg, Inhaber der Professur für Biomechanik und Mitglied bei der Munich School of BioEngineering der TUM, und um Prof. Thomas Crouzier von der KTH haben ein Transportsystem entwickelt, durch das der Wirkstoff nur innerhalb der betroffenen Zellen freigesetzt werden soll. „Die Wirkstoffträger werden zwar von allen Zellen aufgenommen“, erklärt Lieleg. „Aber die Fähigkeit, den Wirkstoff freizusetzen, sollen nur die erkrankten Zellen besitzen.“
Synthetische DNS hält die Wirkstoffträger geschlossen
Die Wissenschaftlerinnen und Wissenschaftler konnten nun zeigen, dass der Mechanismus in Tumor-Modellsystemen aus Zellkulturen funktioniert. Zunächst verpackten sie die Wirkstoffe. Dazu nutzen sie die sogenannten Mucine. Diese sind Hauptbestandteile des Schleims, der zum Beispiel an den Schleimhäuten im Mund, Magen oder Darm gebildet wird. Mucine bestehen aus einem Proteinrückgrat, an das Zuckermoleküle angeheftet sind. „Da Mucine im Körper vorkommen, können geöffnete Mucin-Partikel später von den Zellen abgebaut werden“, sagt Lieleg.
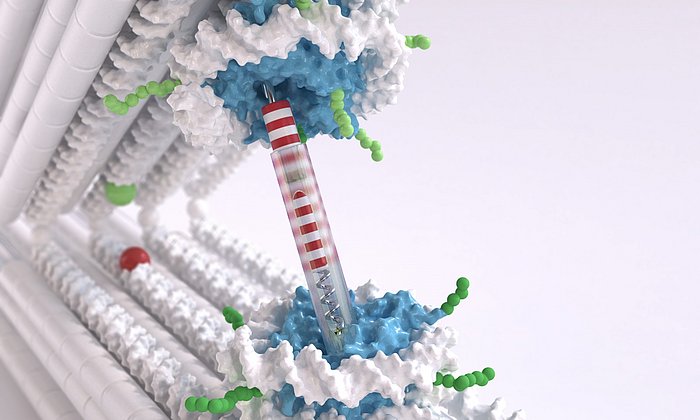
Ein weiterer wichtiger Bestandteil der Verpackung ist ebenfalls im Körper zu finden: die Desoxyribonukleinsäure (DNS), Trägerin unserer Erbinformation. Die Forscherinnen und Forscher stellten DNS-Strukturen mit von ihnen gewünschten Eigenschaften synthetisch her und hefteten sie chemisch an die Mucine. Wird nun der Lösung, in der sich die Mucin-DNS-Moleküle und der Wirkstoff befinden, Glycerin zugesetzt, sinkt die Löslichkeit der Mucine, sie falten sich zusammen und schließen den Wirkstoff ein. Die DNS-Stränge binden sich aneinander und stabilisieren die Struktur, sodass sie sich nicht mehr von alleine auffalten kann.
Das Schloss zum Schlüssel
Nur der richtige "Schlüssel" kann die DNS-stabilisierten Partikel wieder öffnen, sodass die eingekapselten Wirkstoffmoleküle auch freigesetzt werden. Dabei nutzen die Forscherinnen und Forscher sogenannte MikroRNS-Moleküle. RNS oder Ribonukleinsäure ist vom Aufbau der DNS sehr ähnlich und spielt eine große Rolle bei der Proteinsynthese im Körper, kann aber auch andere Zellprozesse regulieren.
"In Krebszellen sind MikroRNS-Stränge vorhanden, deren Aufbau uns genau bekannt ist“, erklärt Ceren Kimna, Erstautorin der Studie. “Um sie als Schlüssel zu nutzen, haben wir das Schloss entsprechend angepasst – durch sorgfältiges Design der synthetischen DNS-Stränge, die unsere Medikamententrägerpartikel stabilisieren.“ Die DNS-Stränge sind so aufgebaut, dass die MikroRNS-Moleküle daran binden können und dadurch die vorhandenen Bindungen, die die Struktur stabilisieren, auflösen. Die synthetischen DNS-Stränge in den Partikeln können auch an Mikro-RNS-Strukturen angepasst werden, die bei anderen Krankheiten wie Diabetes oder Hepatitis auftreten.
Noch ist die klinische Anwendung des neuen Mechanismus nicht erprobt; vorher sind erst weitere Untersuchungen im Labor mit komplexeren Tumor-Modellsystemen erforderlich. Auch wollen die Forscherinnen und Forscher weitere Modifikationen dieses Mechanismus zur Wirkstofffreisetzung untersuchen, um die bestehenden Krebstherapien zu verbessern.
Ceren Kimna, Theresa Monika Lutz, Hongji Yan, Jian Song, Thomas Crouzier, and Oliver Lieleg: DNA Strands Trigger the Intracellular Release of Drugs from Mucin-Based Nanocarriers, ACS Nano
DOI: 10.1021/acsnano.0c04035
- Prof. Lieleg forscht an der Munich School of BioEngineering (MSB). Dieses interdisziplinäre Forschungszentrum der TUM ist europaweit die thematisch umfassendste universitäre Einrichtung für das Schnittfeld von Medizin, Ingenieur- und Naturwissenschaften.
- Bilder zur redaktionellen Verwendung
Technische Universität München
Corporate Communications Center
- Stefanie Reiffert
- stefanie.reiffert@tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Dr. Oliver Lieleg
Technische Universität München
Professur für Biomechanik
Tel: 089/289-10952
oliver.lieleg@tum.de