Organoide helfen, die komplexe Interaktion von Zellen und Gewebe zu entschlüsseln
Mechanische Reize beeinflussen das Organwachstum

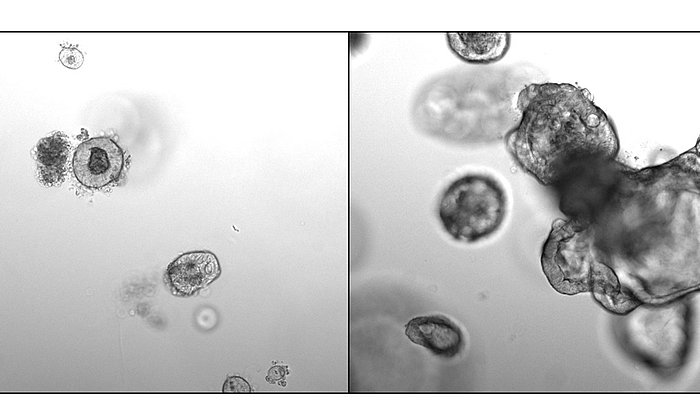
Organoide sind dreidimensionale Modellsysteme für unterschiedliche Organe des Menschen, die im Labor gezüchtet werden und ähnliche Eigenschaften wie das echte Körpergewebe aufweisen. Sie bieten der Wissenschaft neue Möglichkeiten, um Wachstumsprozesse von Organen im Labor nachzubilden und zu untersuchen. Mit den bisher verwendeten vereinfachten zweidimensionalen Modellsystemen waren diese Prozesse bisher nicht beobachtbar.
Indem sie an Brustdrüsen-Organoiden die komplexen Interaktionen der Zellen mit dem umgebenden Gewebe analysierten, konnten Wissenschaftlerinnen und Wissenschaftler der TU München, des Helmholtz Zentrums München und der Ruhr-Universität Bochum zeigen, dass das Wachstum des Drüsengewebes in der menschlichen Brust explizit von den mechanischen Eigenschaften des umgebenden Kollagennetzwerks beeinflusst wird.
Integrierter dynamischer Entwicklungsprozess
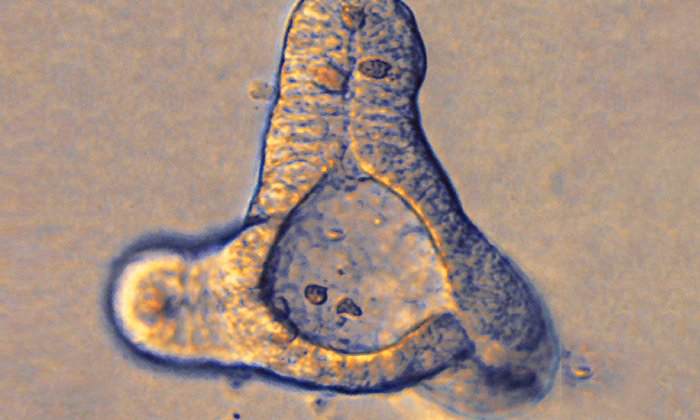
Die vom Team gezüchteten Organoide bilden verzweigte Drüsengänge aus, welche in ihrer Struktur und Organisation der menschlichen Brustdrüse sehr nahekommen. Während des Wachstums dringen die einzelnen Organoidzweige in die umgebende Kollagenmatrix ein.
„Ausgehend von einer einzigen Stammzelle bauen diese Organoide in nur 14 Tagen eine komplexe, verzweigte, dreidimensionale Struktur auf, die aus mehreren tausend Zellen besteht. Das ist absolut faszinierend", sagt Andreas Bausch, Professor für Zellbiophysik an der TU München und Leiter der Forschungsgruppe.
Durch zeitlich aufgelöste Mikroskopie der wachsenden Strukturen über mehrere Tage gelang es dem Forschungsteam, den dynamischen Prozess der Entwicklung im Detail nachzuverfolgen. Dabei fanden sie heraus, dass das Organoidwachstum maßgeblich durch eine kollektive Bewegung der Zellen diktiert wird.
Indem sie sich in Wachstumsrichtung ausdehnen und wieder zusammenziehen, erzeugen die Zellen dabei Kräfte die so stark sind, dass sie die umgebende Kollagenmatrix deformieren und dem Organoid ermöglichen, sein weiteres Wachstum selbstorganisiert auszurichten.
Stabiler Kollagenkäfig
„Möglich ist dies durch die mechanische Plastizität des Kollagens“, sagt Benedikt Buchmann, Erstautor der Studie. „Wenn die einzelnen Zellen sich kollektiv hin und her bewegen, baut sich eine so starke Spannung auf, dass die Zellen eines Zweigs die Kollagenmatrix verformen können.“
Der gesamte Prozess führt zur Bildung eines mechanisch stabilen Kollagenkäfigs, der schließlich den wachsenden Zweig umgibt. Der Kollagenkäfig steuert die weitere Spannungserzeugung, das Heranwachsen der Äste und die plastische Verformung der Matrix.
Aufbauend auf diesen Erkenntnissen ist es nun möglich, mit diesem Modellsystem auch komplexere Prozesse, wie zum Beispiel erste Schritte der Metastasierung oder Wechselwirkungen mit anderen Zelltypen zu untersuchen. Ob dieser Selbstorganisations-Mechanismus auch in anderen Organen vorkommt, wird gerade aktuell intensiv erforscht
Benedikt Buchmann, Lisa K. Engelbrecht, Pablo Fernandez, Franz P. Hutterer, Marion K. Raich, Christina H. Scheel, Andreas R. Bausch
Mechanical plasticity of collagen directs branch elongation in human mammary gland organoids
Nature Communications, May 12, 2021 – DOI: 10.1038/s41467-021-22988-2
Gefördert wurde die Forschungsarbeit durch das European Research Council (ERC) im Rahmen des ERC Synergy Grant „PoInt“ und durch den SFB 1032 der Deutschen Forschungsgemeinschaft (DFG). Partner des Projekts waren das Helmholtz Zentrum München und das St. Josef-Hospital der Ruhr-Universität Bochum.
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Dr. Andreas Bausch
Lehrstuhl für Biophysik (E27) und TUM Center for Protein Assemblies (CPA)
Technische Universität München
Ernst-Otto-Fischer-Straße 8, 85748 Garching
Tel.: +49 89 289 12480
E-Mail: andreas.bausch@tum.de