Neue Technik ermöglicht detaillierten Blick in Mitochondrien
Neuroimaging: Live-Schaltung in die Zelle
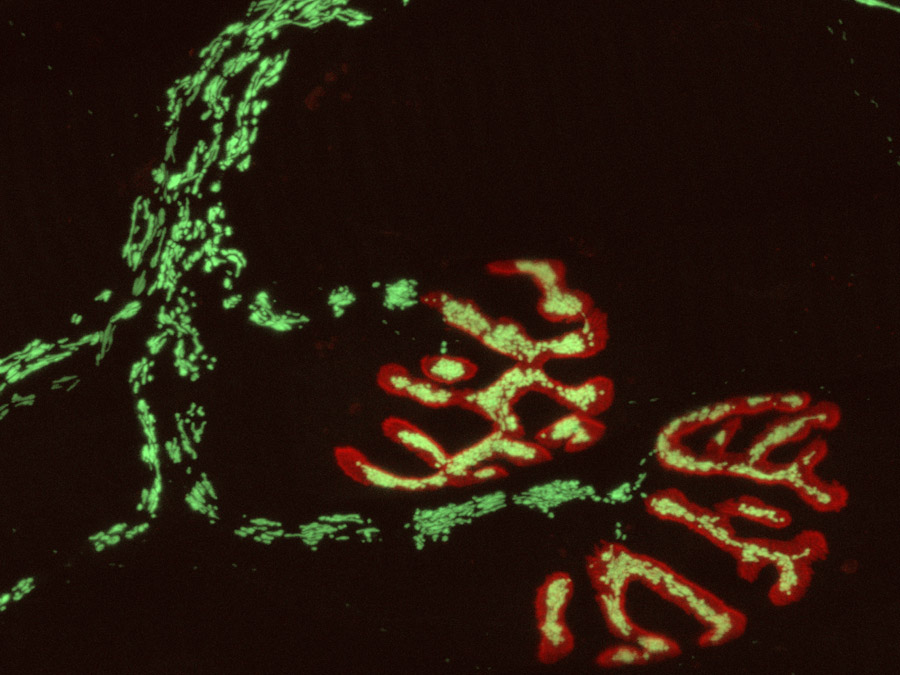
Sauerstoffradikale sind wichtige zelluläre Botenstoffe, allerdings sind ihre Funktionen komplex: In niedriger Konzentration steuern Sauerstoffradikale Funktion und Verhalten von Zellen, werden sie aber in zu hohen Mengen freigesetzt, so kommt es zu sogenanntem „oxidativem Stress“ mit Schädigung von Zellorganellen, Membranen und der Erbsubstanz. Um die Menge und Verteilung von Sauerstoffradikalen und der von ihnen beeinflussten Redoxreaktionen in lebenden Nervenzellen darstellen zu können, haben TUM-Professor Thomas Misgeld und LMU-Professor Martin Kerschensteiner vom Münchner Exzellenzcluster SyNergy (Munich Cluster of Systems Neurology) eine neue bildgebende Technik entwickelt.
„Unser neuer optischer Ansatz erlaubt es, den Oxidationsstatus wichtiger zellulärer Organellen, der Mitochondrien, im lebenden Gewebe – sozusagen live – darzustellen“, sagt Martin Kerschensteiner. Mitochondrien sind die Energielieferanten der Zellen. In früheren Untersuchungen haben Kerschensteiner und Misgeld bereits Hinweise gefunden, dass eine oxidative Schädigung von Mitochondrien am Verlust der Nervenzellfortsätze (Axone) entscheidend beteiligt sein kann, zum Beispiel bei der Multiplen Sklerose.
Die neue Technik erlaubt es nun, die Redoxsignale in Mitochondrien mit hoher zeitlicher und räumlicher Auflösung darzustellen und zu analysieren. „Redoxsignale übernehmen eine wichtige physiologische Signalfunktion, sie können aber bei Erkrankungen des Nervensystems auch schädigend wirken“, erläutert Kerschensteiner den Ausgangspunkt für den neuen bildgebenden Ansatz.
Überraschendes Ergebnis
Für die Darstellung des Oxidationsstatus von Mitochondrien verwenden Kerschensteiner und Misgeld eine Variante des "grün-fluoreszierenden Proteins", die ihre fluoreszenten Eigenschaften in Abhängigkeit vom Oxidationsstatus ändert. „Durch die Kombination mit anderen Biosensoren und Vitalfarbstoffen konnten wir einen Ansatz etablieren, der es uns erlaubt, Redoxsignale gemeinsam mit mitochondrialen Kalziumsignalen sowie Veränderungen des mitochondrialen Potenzials und des pH-Werts zu zeigen“, sagt Thomas Misgeld.
Die Möglichkeiten der neuen Technik haben die Forscher bereits an zwei Beispielen veranschaulicht und dabei überraschende Ergebnisse gewonnen. Zum einen konnten sie erstmals im lebenden Säugernervensystem Redoxsignale nach einer Verletzung einer Nervenverbindung darstellen. Untersuchungen nach einem Rückenmarktrauma zeigen, dass die Verletzung eines Axons von einer Oxidation der Mitochondrien begleitet wird, die sich entlang des geschädigten Axons ausbreitet. Entscheidend für die Schädigung der Mitochondrien ist dabei der Einstrom von Kalzium an der Durchtrennungsstelle des Axons.
Zudem entdeckte Michael Breckwoldt von der LMU, Erstautor der Studie, dass sich einzelne Mitochondrien im Nervensystem kontrahieren können. Diese mitochondrialen Kontraktionen gehen mit schnellen Redoxsignalen einher und nehmen zu, wenn die Nervenzelle stimuliert wird. „Dies scheint ein Sicherungssystem bei Stress zu sein, das reversibel die Funktion der Mitochondrien bremst. Unter pathologischen Bedingungen verlängern sich die Kontraktionen und diese werden zum Teil irreversibel, was zu einer permanenten Schädigung führen kann“, erläutert Thomas Misgeld das überraschendste Ergebnis der Analyse.
Publikation:
Michael O. Breckwoldt, Franz Pfister, Peter M. Bradley, Petar Marinković, Philip R. Williams, Monika S. Brill, Barbara Plomer, Anja Schmalz, Daret K. St. Clair, Ronald Naumann, Oliver Griesbeck, Markus Schwarzländer, Leanne Godinho, Florence M. Bareyre, Tobias P. Dick, Martin Kerschensteiner and Thomas Misgeld, Multi-parametric optical analysis of mitochondrial redox signals during neuronal physiology and pathology in vivo, Nature Medicine (2014).
DOI: 10.1038/nm.3520
Kontakt
Prof. Dr. Martin Kerschensteiner
Institut für Klinische Neuroimmunologie an der LMU
Tel: +49 89 2180 78282
Martin.Kerschensteiner@med.uni-muenchen.de
AG Kerschensteiner
Prof. Dr. Thomas Misgeld
Institut für Neurowissenschaften der TUM
Tel: + 49 89 4140 3512
thomas.misgeld@lrz.tum.de
Misgeld-Lab
Technische Universität München
Corporate Communications Center
- Nicola Holzapfel (LMU) / Dr. Vera Siegler
- siegler@zv.tum.de
- presse@tum.de
- Teamwebsite