Neuer Mechanismus zur Hemmung des Immunoproteasoms aufgeklärt
Zielgenau gegen Autoimmunkrankheiten und chronische Entzündungen
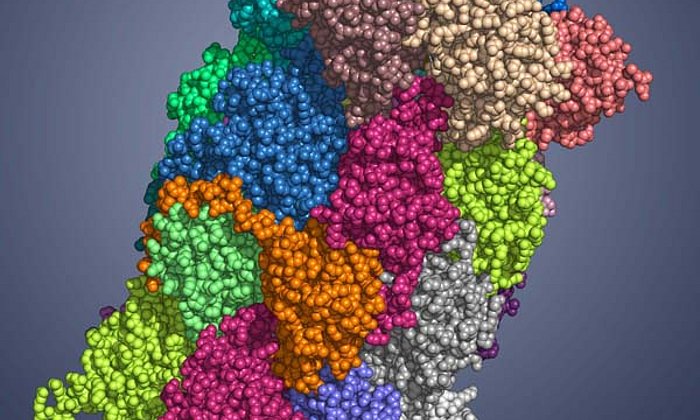
Das Immunsystem fungiert als Polizei des Körpers und schützt uns vor Eindringlingen wie Bakterien und Viren. Um zu erfahren, was in der Zelle vor sich geht, benötigt es aber Informationen über den Fremdkörper. Diese Aufgabe übernimmt das sogenannte Immunoproteasom. Es handelt sich dabei um einen zylinderförmigen Proteinkomplex, der Eiweißstrukturen des Eindringlings in Bruchstücke zerlegt und diese dem Abwehrsystem zur Verfügung stellt.
"Bei Autoimmunerkrankungen wie Rheuma, Diabetes Typ I und Multipler Sklerose oder schweren Entzündungen ist oftmals eine deutlich erhöhte Konzentration des Immunoproteasoms in der Zelle messbar", erklärt Prof. Michael Groll vom Lehrstuhl für Biochemie der TUM. "Eine Inaktivierung dieser Abbaumaschinerie unterdrückt die Neubildung von Immunbotenstoffen, was wiederum eine übermäßige Immunreaktion verhindert."
Feine, aber wesentliche Unterschiede
Bereits seit Längerem sind Wissenschaftler auf der Suche nach neuen Wirkstoffen, die das Immunoproteasom gezielt hemmen, ohne das ebenfalls in der Zelle vorkommende konstitutive Proteasom zu beeinträchtigen. Das konstitutive Proteasom baut gezielt fehlerhafte oder nicht mehr benötigte Eiweiße ab und übernimmt damit das zelluläre Recycling. Werden sowohl das konstitutive Proteasom als auch das Immunoproteasom gehemmt, führt dies zum Tod der Zelle.
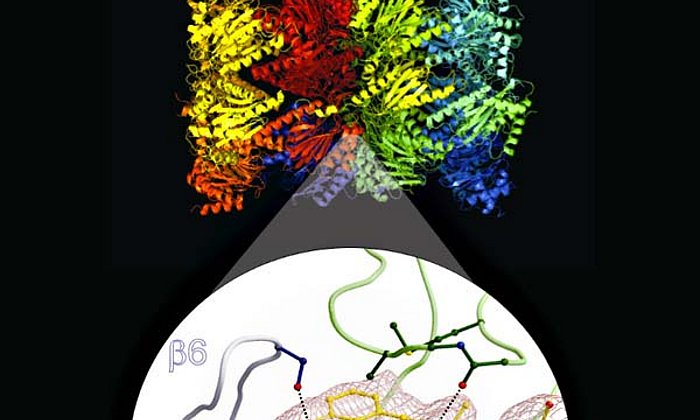
Eine Voraussetzung für das Design eines spezifischen Wirkstoffs schuf die Forschergruppe um Groll Anfang 2012: Sie entschlüsselte die Kristallstruktur des Immunoproteasoms. So war es möglich, die feinen, aber wesentlichen Unterschiede zwischen den nahezu identisch aufgebauten Strukturen zu erkennen.
Besonderer Wirkmechanismus
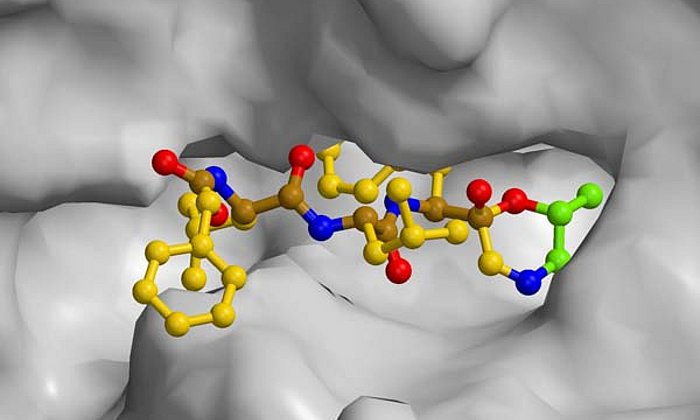
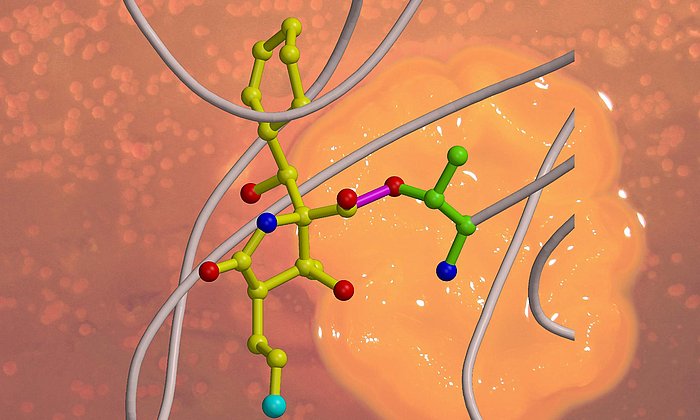
Der potenzielle Wirkstoff, den die Wissenschaftler nun entwickelten, basiert auf dem Epoxyketon ONX 0914, einem Immunoproteasom-Hemmer, der in klinischer Phase getestet wurde. Die Forscher ersetzten das Epoxyketon durch eine Sulfonylfluorid-Gruppe und veränderten deren Positionierung am Inhibitor. Als Ergebnis erhielten die Forscher eine neue Verbindung, die speziell das Immunoproteasom hemmt und auf das konstitutive Proteasom kaum Einfluss hat.
Die Besonderheit des entdeckten Mechanismus erklärt Erstautor Christian Dubiella: "Normalerweise verstopfen Inhibitoren das aktive Zentrum des Enzyms und legen somit dessen Funktion lahm. Die von uns synthetisierte Substanz jedoch bindet an ihr Ziel, veranlasst das aktive Zentrum, sich selbst zu zerstören, und spaltet sich nach verrichteter Arbeit wieder ab." Vor allem Einblicke in den atomaren Mechanismus, welcher mittels Röntgenstrukturanalyse aufgeklärt wurde, ermöglicht die maßgeschneiderte Entwicklung von neuen Immunoproteasom-Inhibitoren. Damit könnte der Weg für eine zukünftige Generation an Wirkstoffen offen stehen.
Über das Projekt:
Die Forschung wurde in Zusammenarbeit mit den Arbeitsgruppen um Prof. Stephan Sieber vom Lehrstuhl für Organische Chemie II, Prof. Achim Krüger vom Institut für Experimentelle Onkologie und Therapieforschung der TUM sowie Prof. Robert Liskamp von der Universität Glasgow durchgeführt.
Die Arbeiten wurden mit Mitteln der Deutschen Forschungsgemeinschaft (SFB 1035/A2 & DFG GR 1861/10-1) sowie des Exzellenzclusters Center for Integrated Protein Science Munich (CIPSM) gefördert. Die röntgenkristallographischen Messungen wurden an der PXI-Beamline des Paul Scherrer Institut (Villigen, Schweiz) durchgeführt.
Originalpublikation:
Selective Inhibition of the Immunoproteasome by Ligand-Induced Crosslinking of the Active Site, Christian Dubiella, Haissi Cui, Malte Gersch, Arwin J. Brouwer,Stephan A. Sieber, Achim Krüger, Rob M. J. Liskamp, Michael Groll, Angewandte Chemie Int. Ed., DOI: 10.1002/anie.201406964
Bildmaterial
Kontakt:
Prof. Dr. Michael Groll
Technische Universität München
Lehrstuhl für Biochemie
+49 89 289 13361
michael.groll@tum.de
http://www.biochemie.ch.tum.de/
Technische Universität München
Corporate Communications Center
- Stefanie Reiffert
- reiffert@zv.tum.de
- presse@tum.de
- Teamwebsite