Beta-Lakton stört Mykomembran-Biosynthese und verstärkt Antibiotikawirkung
Doppelschlag gegen Tuberkulose

Eine der größten Herausforderungen bei der Behandlung lebensgefährlicher Tuberkulose-Infektionen ist die wachsende Zahl von Antibiotika-Resistenzen. Aber auch der Erreger selbst macht es den Medizinern schwer: Seine dichte Mykomembran mindert die Wirkung vieler Pharmaka.
Angeführt von Stephan A. Sieber, Professor für Organische Chemie an der TU München, haben Wissenschaftlerinnen und Wissenschaftler eine Substanz entdeckt, die gerade den Aufbau dieser Membran empfindlich stört.
Die Mykomembran des Tuberkulose-Erregers Mycobacterium tuberculosis ist eine Lipid-Doppelschicht, die die Zellwand umhüllt und eine äußere Barriere bildet. Ein wesentlicher Strukturbaustein sind Mykolsäuren, verzweigte ß-Hydroxy-Fettsäuren mit zwei langen Kohlenwasserstoffketten. Ähnlich aufgebaute beta-Laktone sollten, so die Hypothese des Teams, sich als Mykolsäure „tarnen“, den gleichen Stoffwechselweg wie diese gehen und die entscheidenden Enzyme blockieren können.
Hilfreicher Störenfried
Im Rahmen einer umfangreichen Suche landete die interdisziplinäre Wissenschaftlergruppe mit dem beta-Lakton „EZ120“ einen Volltreffer. Tatsächlich hemmt es die Biosynthese der Mykomembran und tötet Mykobakterien effektiv ab.
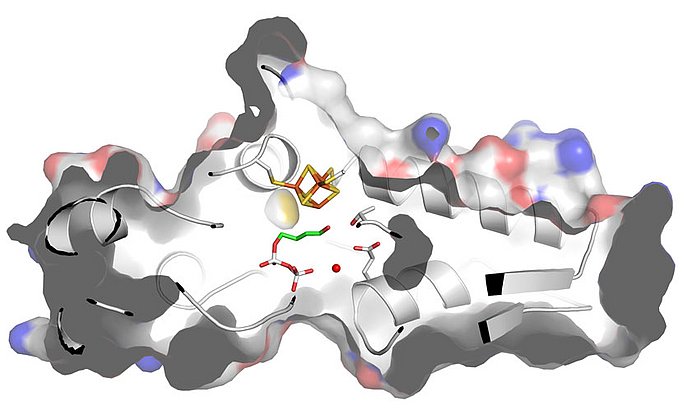
Dr. Johannes Lehmann, Mitarbeiter am Lehrstuhl für Organische Chemie II der TU München, konnte während seiner Promotion mithilfe von Enzymtests und massenspektrometrischen Untersuchungen zeigen, dass der neue Inhibitor vor allem die Enzyme Pks13 und Ag85 blockiert, die eine entscheidende Rolle beim Aufbau der Mykomembran spielen.
EZ120 wirkt bereits in geringer Dosis, kann die Mykomembranen gut überwinden und zeigt nur eine geringe Toxizität gegenüber menschlichen Zellen. Wird die Substanz gemeinsam mit bekannten Antibiotika verabreicht, steigert es deren Wirksamkeit erheblich.
„Vancomycin, ein gängiges Antibiotikum, und EZ120 arbeiten hervorragend zusammen“, sagt Prof. Sieber, Inhaber des Lehrstuhls für Organische Chemie II. „Bei einer gemeinsamen Anwendung lässt sich die eingesetzte Dosis um mehr als das 100-fache reduzieren.“
Die Wissenschaftler vermuten, dass die Schwächung der Mykomembran die Antibiotika leichter in die Bakterien eindringen lässt. Dies könnte ein Ansatzpunkt für neuartige Tuberkulose-Therapien sein.
Die Forschungsarbeit wurde unterstützt mit Mitteln der Deutschen Forschungsgemeinschaft (SFB 749 und Exzellenzcluster Center for Integrated Protein Science), der National Institutes of Health (USA) und der Studienstiftung des Deutschen Volkes. An der Forschungsrabeit waren außerdem Wissenschaftlerinnen und Wissenschaftler der Harvard T.H. Chan School of Public Health und der Texas A&M University (College Station, USA) beteiligt.
Publikation:
Johannes Lehmann, Tan-Yun Cheng, Anup Aggarwal, Annie S. Park, Evelyn Zeiler, Ravikiran M. Raju, Tatos Akopian, Olga Kandror, James C. Sacchettini, D. Branch Moody, Eric J. Rubin und Stephan A. Sieber: Ein antibakterielles beta-Lacton bekämpft Mycobacterium tuberculosis durch Infiltration der Mykolsurebiosynthese, Angew. Chem. 2017. – DOI: 10.1002/ange.201709365
Kontakt:
Prof. Dr. Stephan A. Sieber
Technische Universität München
Lehrstuhl für Organische Chemie II
Lichtenbergstr. 4, 85748 Garching, Germany
Tel.: +49 89 289 13302 - E-Mail - Internet
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite