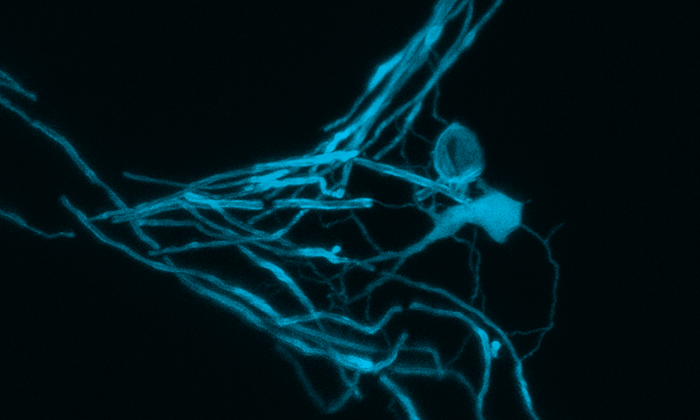
Multiple Sklerose: Absterben von Nervenzellfortsätzen durch Kalziumeinstrom
Gefährliche Risse
Alleine in Deutschland leben mehr als 200.000 Patientinnen und Patienten mit Multipler Sklerose (MS). Es ist eine der häufigsten entzündlichen Erkrankungen des Zentralen Nervensystems. Bei dieser Autoimmunerkrankung hängt das Ausmaß der bleibenden Behinderung entscheidend davon ab, wie viele der langen Nervenzellfortsätze, der sogenannten Axone, absterben. Ein Team um Prof. Thomas Misgeld vom Institut für Neuronale Zellbiologie der TUM und Prof. Martin Kerschensteiner, Direktor des Instituts für Klinische Neuroimmunologie der LMU, hat in einer neuen Studie diesen Mechanismus anhand eines Tiermodells genauer untersucht. Sie berichteten über ihre Ergebnisse im Fachmagazin „Neuron".
Kalziumgehalt bestimmt Schicksal der Axone
Bereits in früheren Studien beobachteten die Forscherinnen und Forscher, dass Axone in der Nähe von entzündlichen Läsionen häufig anschwellen und anschließend zugrunde gehen können. „Einige Axone erholen sich aber spontan und schwellen wieder ab“, sagt Martin Kerschensteiner. „Der Prozess ist also grundsätzlich reversibel und könnte daher möglicherweise therapeutisch beeinflusst werden, wenn wir die Mechanismen besser verstehen.“
Wie das Team nun in einem Tiermodell für MS mithilfe eines in-vivo Mikroskopie-Ansatzes zeigen konnten, hängt das Schicksal der Axone mit ihrem Kalziumgehalt zusammen: Axone mit einem erhöhten Kalziumspiegel haben ein hohes Risiko, anzuschwellen und geringe Chancen, sich von dem geschwollenen Zustand wieder zu erholen. „Dabei beginnen die Veränderungen schon relativ früh“, sagt Thomas Misgeld. Auch zehn Prozent der noch nicht angeschwollenen Axone zeigen bereits einen erhöhten Kalziumspiegel. Bei den geschwollenen Axonen hat etwa die Hälfte hohe Kalziumgehalte und entsprechend ein sehr hohes Risiko, abzusterben.
Risse als Eintrittspforte für Kalzium
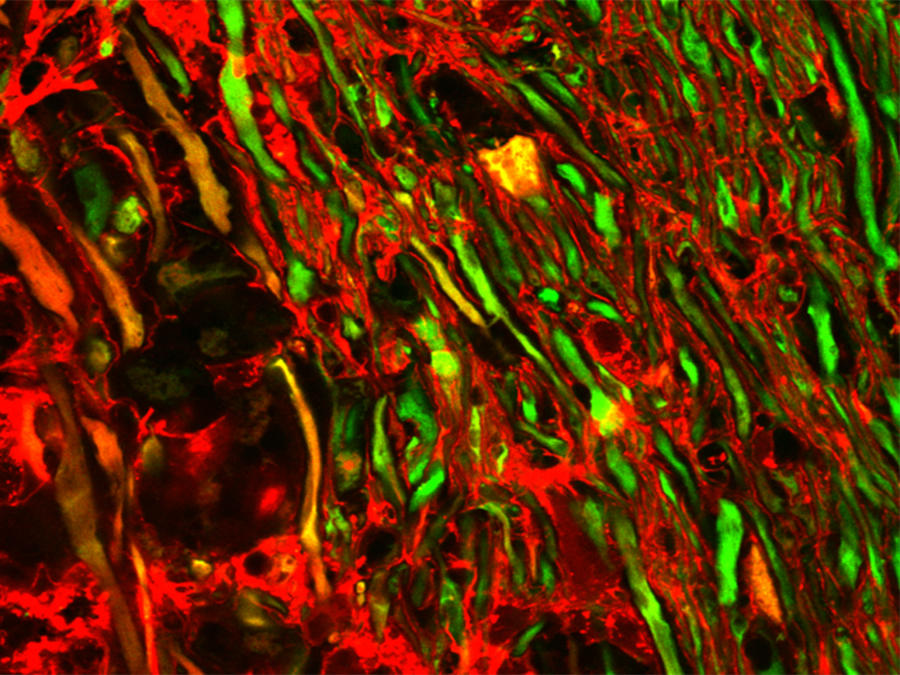
Das überschüssige Kalzium stammt aus dem extrazellulären Raum und dringt durch winzige Risse in der Zellmembran in das Axon ein, wie die Wissenschaftlerinnen und Wissenschaftler mithilfe eines an ein Makrokmolekül gekoppelten Fluoreszenzfarbstoffs nachwiesen. Der Farbstoff ist normalerweise zu groß, um in ein intaktes Axon einzudringen. Nur wenn die Membran geschädigt ist, wird der Farbstoff aufgenommen und das Axon angefärbt. „Mit Hilfe der in-vivo Mikroskopie konnten wir weiterhin beobachten, dass die Axone, die den Farbstoff aufnehmen, auch einen erhöhten Kalziumgehalt zeigen“, sagt Martin Kerschensteiner.
Und Thomas Misgeld fügt hinzu: „Dass Risse in der Zellmembran auch im entzündeten Nervensystem zum Absterben vom Nervenfasern beitragen können, ist eine neue Erkenntnis, die in Zukunft auch therapeutisch relevant sein könnte.“ So ist aus Untersuchungen von Rückenmarksverletzungen bekannt, dass Nervenfasern zumindest durch mechanische Verletzungen entstandene Risse wieder heilen können. Deshalb hoffen die Wissenschaftlerinnen und Wissenschaftler, dass ein besseres Verständnis der Entstehung und Reparatur der Risse ein wichtiger Schritt hin zu neuen therapeutischen Angriffszielen sein könnte.
Publikation:
Witte et al., Calcium influx through plasma-membrane nanoruptures drives axon degeneration in a model of multiple sclerosis, Neuron, January 24, 2019, DOI: 10.1016/j.neuron.2018.12.023 (Open Access).
Mehr Informationen:
Prof. Thomas Misgeld und Prof. Martin Kerschensteiner sind Mitglieder des Exzellenzclusters „SyNergy – Munich Cluster for Systems Neurology“, das auch in der kommenden Exzellenzinitiative gefördert wird.
- Profil von Prof. Thomas Misgeld
- Webseite des Institut für Zellbiologie des Nervensystems (nur auf Englisch)
- Webseite des SyNergy-Clusters
Kontakt:
Prof. Thomas Misgeld
Institut für Zellbiologie des Nervensystems
Technische Universität München
Tel.: +49 (0)89 - 4140-3512
thomas.misgeld@tum.de
Technische Universität München
Corporate Communications Center
- Dr. Vera Siegler
- vera.siegler@tum.de
- presse@tum.de
- Teamwebsite