Erstmals früher Schritt der zellulären Störung bei Alzheimer erkannt
Eine direkte toxische Wirkung von beta-Amyloid aufgeklärt

In Gehirnen von Alzheimer-Patienten, die schon Symptome zeigen, finden sich große Verklumpungen des Proteins beta-Amyloid, die sogenannten Plaques. Viele therapeutische Ansätze setzen darauf, diese Verklumpungen zu entfernen. Bisher aber ohne weitreichenden Erfolg.
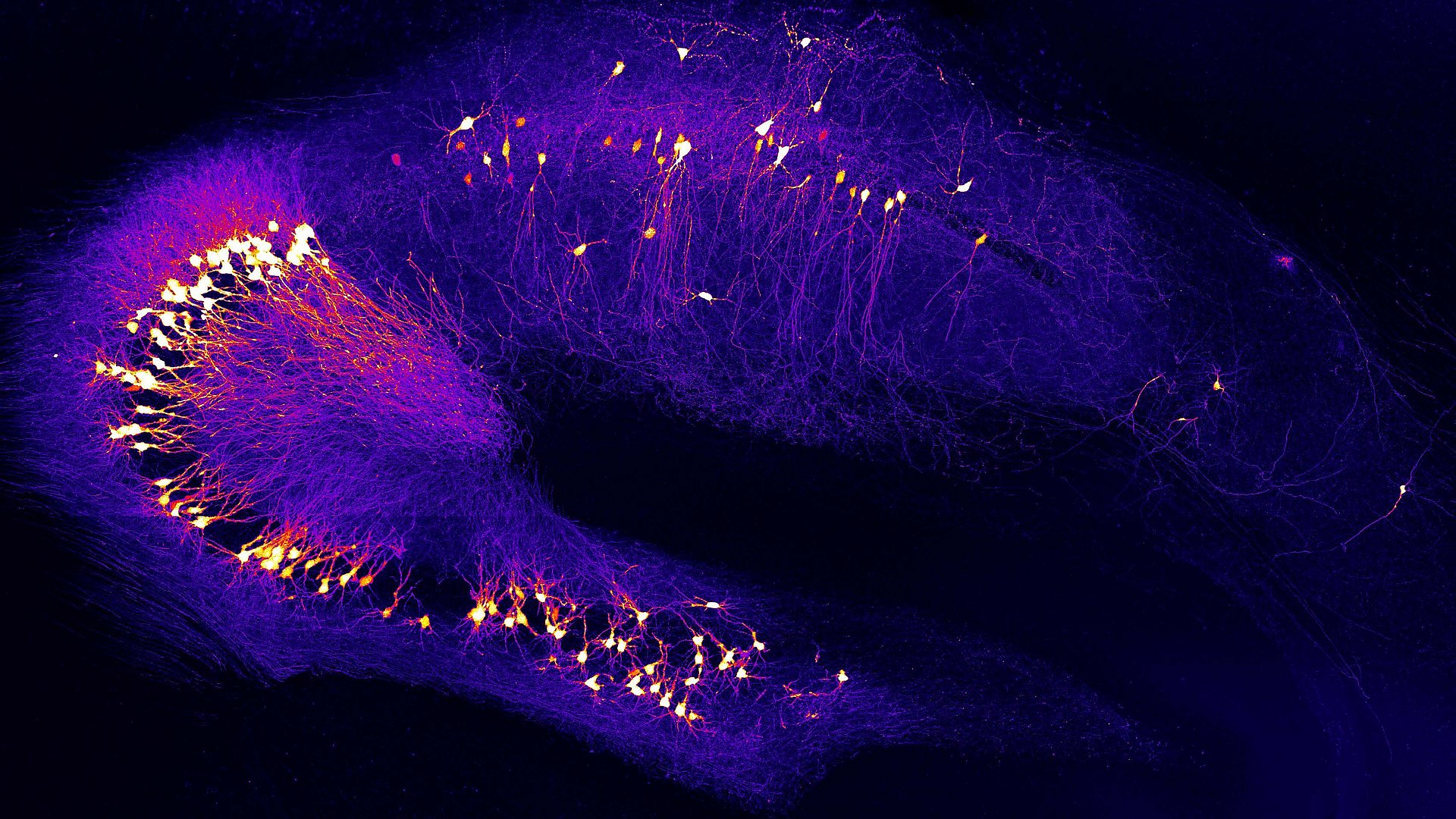
„Entscheidend ist, dass wir die Krankheit viel früher erkennen und behandeln. Unsere Ansatzpunkte waren deshalb die überaktiven Nervenzellen, die schon sehr früh auftreten – lange bevor die Patientin oder der Patient Gedächtnisausfälle hat“, erklärt Prof. Arthur Konnerth, Hertie Senior Professor für Neurowissenschaften an der TUM. Durch die Überaktivierung erhalten benachbarte Zellen ständig falsche Signale und bringen so die Signalverarbeitung durcheinander.
Konnerth gemeinsam mit seinem Doktoranden Benedikt Zott und dem gesamten Team war es möglich, die Ursache, den Auslöser und damit auch mögliche neue therapeutische Angriffspunkte für diese frühe Störung im Gehirn zu entdecken. Die Studie wurde im Fachjournal „Science“ veröffentlicht.
Beta-Amyloid blockiert Glutamat-Wiederaufnahme
Wenn Nervenzellen miteinander kommunizieren, nutzen sie Botenstoffe, sogenannte Neurotransmitter. Glutamat, eine der wichtigsten dieser Substanzen, aktiviert Nervenzellen. Dafür wird es in den Bereich zwischen zwei Nervenzellen, den synaptischen Spalt, abgegeben, wo es wirken kann. Anschließend müssen die Glutamat-Moleküle von dort wieder schnell entfernt werden, um die Wirkung zu beenden. Dieser Vorgang findet zum einen aktiv über sogenannte Pumpmoleküle statt, zum anderen passiv durch einfachen Transport des Glutamats entlang der Membranen.
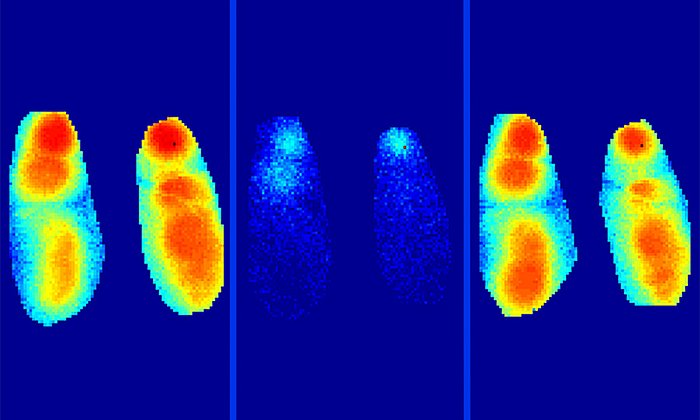
Wie die Forscherinnen und Forscher herausfanden, befand sich bei den überaktiven Nervenzellen Glutamat zu lange in sehr hohen Konzentrationen im synaptischen Spalt. Sie konnten zeigen, dass bei diesen Nervenzellen der Transport des Hirnbotenstoffs gestört war. Der Grund hierfür waren beta-Amyloid-Moleküle, die die Nervenzellmembranen für den Transport von Glutamat blockierten. Sie verwendeten für den Nachweis dieses Mechanismus sowohl beta-Amyloid-Moleküle aus Patientenproben als auch Mausmodelle – mit dem gleichen Ergebnis.
Hinweis auf möglichst frühen Therapieansatz
Interessant war für das Team auch, dass diese Blockade schon von einer frühen löslichen Form des beta-Amyloids ausgelöst wurde und nicht von den verklumpten Plaques. Beta-Amyloid tritt in unterschiedlichen Formen auf: Es wird als einzelnes Molekül gebildet und formt dann zuerst lösliche Zweierkonstrukte (Dimere) und später lange Ketten, die die Plaques bilden. Im Falle der Glutamat-Blockade waren die Dimere der Auslöser.
„Unsere Daten liefern einen klaren Beweis für eine direkte toxische Wirkung einer bestimmten beta-Amyloid-Form, den Dimeren. Wir waren sogar in der Lage diesen Mechanismus zu erklären“, so Benedikt Zott, Erstautor der Studie. Dieses Wissen wollen die Forscherinnen und Forscher nun nutzen, um das Verständnis der zellulären Ursachen bei der Entstehung von Alzheimer weiter zu verbessern und so Therapiestrategien zu entwickeln, die früh im Krankheitsverlauf ansetzen.
Benedikt Zott, Manuel M. Simon, Wei Hong, Felix Unger, Hsing-Jung Chen-Engerer, Matthew P. Frosch, Bert Sakmann, Dominic M. Walsh, Arthur Konnerth, A vicious cycle of beta-amyloid-dependent neuronal hyperactivation, Science, August 9, 2019; DOI: 10.1126/science.aay0198
Prof. Arthur Konnerth ist Mitglied des Exzellenzclusters „SyNergy – Munich Cluster for Systems Neurology“. Der Cluster erforscht, auf welche Weise neurologische Erkrankungen wie Alzheimer und Multiple Sklerose entstehen. Weil das Nervensystem hochkomplex ist, beeinflussen dort zahlreiche Prozesse die Entstehung neurodegenerativer Krankheiten. Im Mittelpunkt der Münchner Forschung steht die Systemneurologie als neuer interdisziplinärer Ansatz. Der Cluster wird schon seit 2012 von der Exzellenzinitiative gefördert. Neben TUM und LMU als gemeinsame Antragsteller sind das Deutsche Zentrum für Neurodegenerative Erkrankungen, das Helmholtz Zentrum München und die Max-Planck-Institute für Biochemie, Neurobiologie und Psychiatrie an SyNergy beteiligt.
Technische Universität München
Corporate Communications Center
- Dr. Vera Siegler
- vera.siegler@tum.de
- +49 (0)89 289 23325
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Arthur Konnerth
Hertie Senior Professur für Neurowissenschaften
Institut für Neurowissenschaften der Technischen Universität München
Tel.: +49-89-4140-3350
Mail: arthur.konnerth@tum.de