Schutzprotein in der Augenlinse beeinflusst auch Oxidation von Proteinen
Schutzpatron des Auges
Die Brechkraft der menschlichen Augenlinse beruht auf einer hochkonzentrierten Eiweißlösung. Diese Proteine werden in der Embryonalentwicklung angelegt und müssen dann ein Leben lang funktionieren, weil die Linse keine Maschinerie zum Auf- und Abbau von Proteinen besitzt.
Werden die Linsenproteine geschädigt, kommt es zu Grauem Star – einer Eintrübung der Augenlinse – und Alterssichtigkeit. Schutzproteine sorgen deshalb dafür, dass die Proteine des Auges auch bei ungünstigen Umwelteinflüssen ihre Form bewahren.
„Die beiden Schutzproteine αA- und αB-Kristallin machen rund 30 Prozent der Proteine im menschlichen Auge aus“ und sind für die Funktion der Linse enorm wichtig, sagt Christoph Kaiser, Erstautor der Publikation im Fachjournal Nature Structural and Molecular Biology.
Struktur eines wandlungsfähigen Proteins
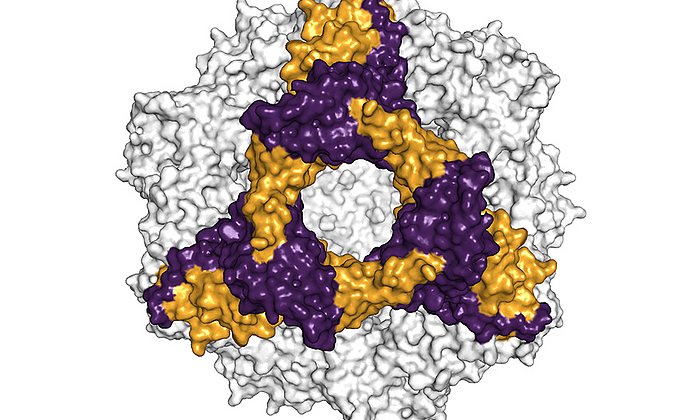
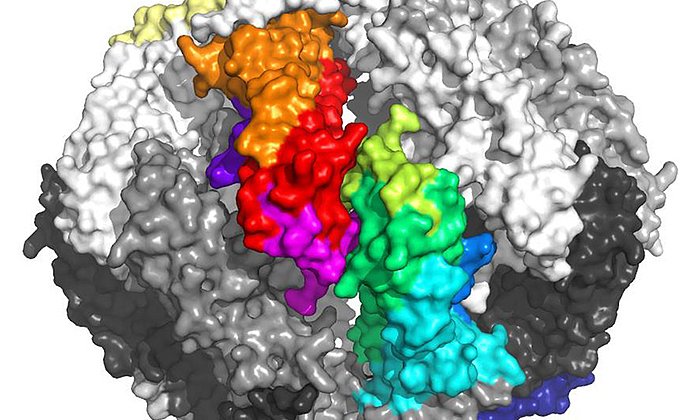
Seit mehr als 40 Jahren wurde vergeblich versucht, die Struktur des alpha-A-Kristallins zu ermitteln. Der Durchbruch gelang nun einem Forschungsteam um die beiden TUM-Professoren Sevil Weinkauf, Professorin für Elektronenmikroskopie und Johannes Buchner, Professor für Biotechnologie, durch Kombination von Kryo-Elektronenmikroskopie, Massenspektrometrie, NMR-Spektroskopie und molekularer Modellierung.
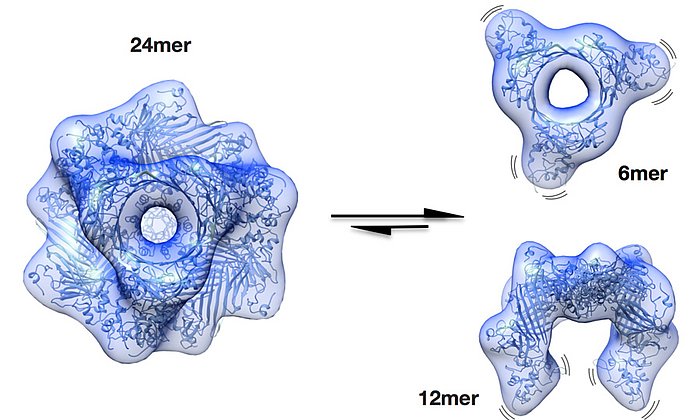
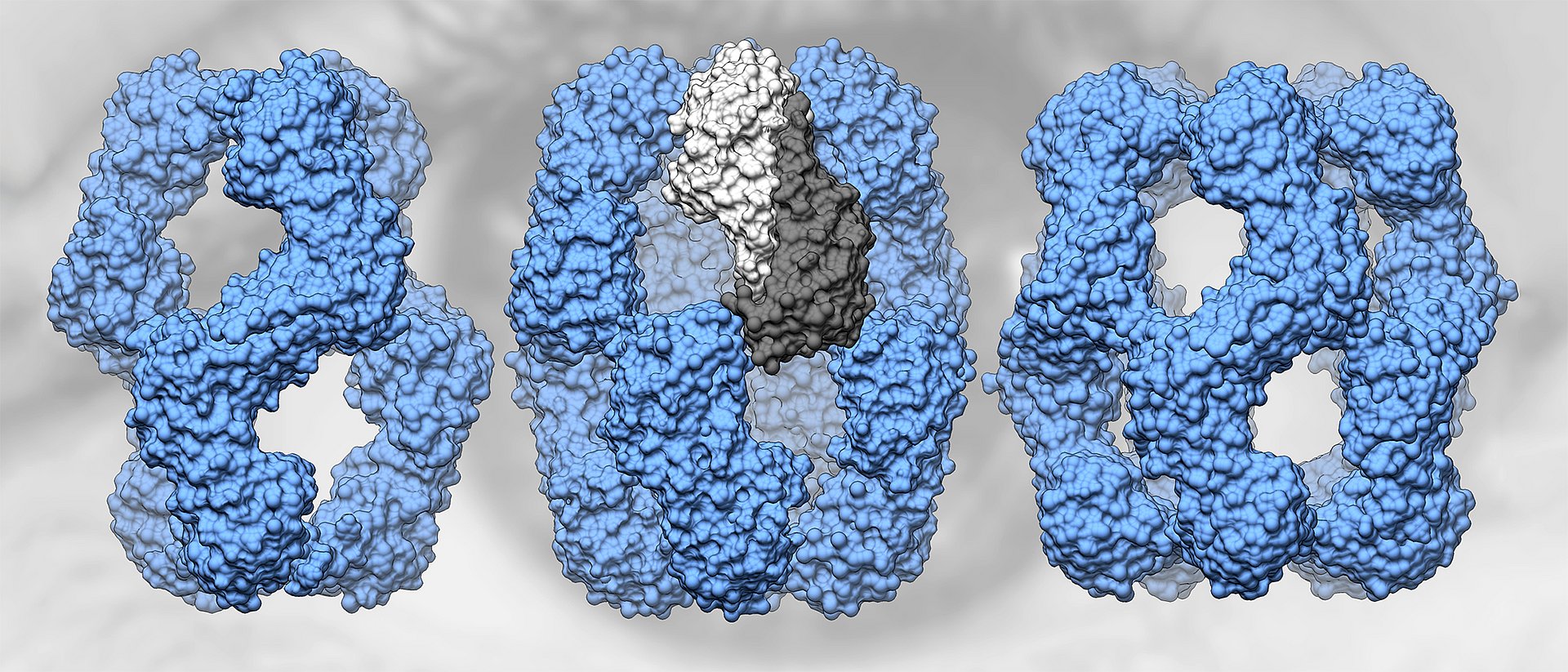
„Das αA-Kristallin ist extrem vielgestaltig“, sagt Sevil Weinkauf. „Das macht es sehr schwierig, die Struktur zu ermitteln. Erst durch die Entwicklung einer neuen Strategie zur Datenanalyse konnten wir zeigen, dass es in Lösung in verschiedenen Strukturen mit 12, 16 oder 20 Untereinheiten vorliegt.“
Schutz vor Oxidation
Die typische Funktion von Schutzproteinen ist es, anderen Proteinen bei Stress, beispielsweise durch hohe Temperaturen, dabei zu helfen, ihre Form zu bewahren. Man nennt sie daher auch Chaperone, zu Deutsch Anstandsdamen.
Auch αA- und αB-Kristallin haben diese Funktion. Darüber hinaus besitzt menschliches αA-Kristallin zwei Cysteinreste, deren Schwefelatome Disulfidbrücken bilden können. Eingehendere biochemische Untersuchungen zeigten, dass sich diese Verbrückung erheblich auf verschiedene Eigenschaften des Proteinmoleküls auswirkt.
„Eine gängige Theorie ist, dass die Disulfidbrücken Ergebnis einer Schädigung des Proteins beispielsweise durch Sauerstoff sind“, sagt Johannes Buchner. „Unsere Ergebnisse legen nahe, dass das alpha-A-Kristallin eine aktive Rolle zum Schutz anderer Proteine vor Oxidation spielen könnte.“
Anstoß für weitere Forschung
Die Untersuchungen des Forschungsteams zeigten, dass oxidiertes αA-Kristallin die vorhandene Disulfidbrücke sogar auf andere Proteine übertragen kann. „Diese Fähigkeit entspricht der einer Proteindisulfid-Oxidase“, sagt Christoph Kaiser. „αA-Kristallin kann also den Redoxzustand anderer Linsenproteine beeinflussen. Diese Funktion erklärt auch, dass schon im Embryo etwa die Hälfte der αA-Kristalline solche Disulfidbrücken besitzt.“
„Rund 35 Prozent aller Erblindungen sind auf den „Grauen Star“ zurückzuführen“, sagt Sevil Weinkauf. „Das molekulare Verständnis der Funktionen der Augenlinsenproteine ist eine wichtige Grundlage, um Präventions- und Therapiestrategien zu entwickeln. Die Erkenntnis, dass αA-Kristallin auch beim Oxidationsschutz eine wichtige Rolle spielt, wird nun weitere Forschung nach sich ziehen.“

Christoph J. O. Kaiser, Carsten Peters, Philipp W. N. Schmid, Maria Stavropoulou, Juan Zou, Vinay Dahiya, Evgeny V. Mymrikov, Beate Rockel, Sam Asami, Martin Haslbeck, Juri Rappsilber, Bernd Reif, Martin Zacharias, Johannes Buchner & Sevil Weinkauf
The structure and oxidation of the eye lens chaperone αA-crystallin
Nature Structural & Molecular Biology volume 26, 1141–1150 (2019) – DOI: 10.1038/s41594-019-0332-9
Diese Arbeiten wurden unterstützt mit Mitteln der Deutschen Forschungsgemeinschaft (SFB 1035 und Exzellenzcluster Center for Integrated Protein Science Munich) und des Wellcome Trust. Beteiligt waren Wissenschaftlerinnen und Wissenschaftler der TU München, des Institute of Structural Biology des Helmholtz Zentrum München, des Instituts für Biotechnologie der Technischen Universität Berlin und des Wellcome Centre for Cell Biology der University of Edinburgh (UK).
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Prof. Dr. Sevil Weinkauf
Professur für Elektronenmikroskopie
Technische Universität München
Lichtenbergstraße 4, 85748 Garching
Tel.: +49 89 289 13517
sevil.weinkauf@ch.tum.de