Neuer Mechanismus hinter der Wirkung von Hautkrebs-Medikament Imiquimod entschlüsselt
Ein Wirkstoff, verschiedene Wirkungen

Dass ein Medikament für den Gebrauch zugelassen ist, bedeutet nicht automatisch, dass seine Wirkungsweise vollständig erforscht und verstanden worden ist. Neue Erkenntnisse und technische Möglichkeiten erlauben immer genauere Einblicke in die Abläufe innerhalb des menschlichen Körpers. Dadurch wird auch klarer, wie bekannte Arzneien wirken und welche Ansätze für neue Medikamente sinnvoll sein könnten.
PD Dr. Olaf Groß, Gruppenleiter am Institut für Klinische Chemie und Pathobiochemie der TUM, und sein Team haben mit Imiquimod ein Medikament unter die Lupe genommen, mit dem seit 1997 erfolgreich virale Infektionen der Haut und bestimmte Formen von Hautkrebs behandelt werden. Ihre Ergebnisse veröffentlichten die Wissenschaftlerinnen und Wissenschaftler im Fachmagazin „Immunity“.
Als sogenannter Immunmodulator löst Imiquimod eine Immunreaktion aus, die dazu führt, dass das körpereigene Abwehrsystem die veränderten Zellen bekämpft. Dieser Prozess war lange der einzige bekannte Wirkungsmechanismus des Medikaments. Mittlerweile ist aber erwiesen, dass es weitere Prozesse im Körper startet: Zum einen beeinflusst der Wirkstoff direkt das Wachstum von Krebszellen. Zum anderen aktiviert Imiquimod einen Proteinkomplex, der Entzündungsprozesse im Körper steuert und als Inflammasom bezeichnet wird. Der Begriff „Entzündung“ mag zunächst negative Assoziationen hervorrufen, im Normalfall unterstützen Entzündungsprozesse aber die Bekämpfung von Fremdkörpern und veränderten Zellen. Das Inflammasom kann sowohl zu diesen Schutzmechanismen beitragen, aber auch zerstörerisch wirken, wenn es überreagiert. „Wir nehmen an, dass diese anderen Wirkungsmechanismen von Imiquimod zu den positiven Auswirkungen des Medikaments oder zu seinen Nebenwirkungen beitragen“, sagt Olaf Groß.
Eingriff in die Atmungskette
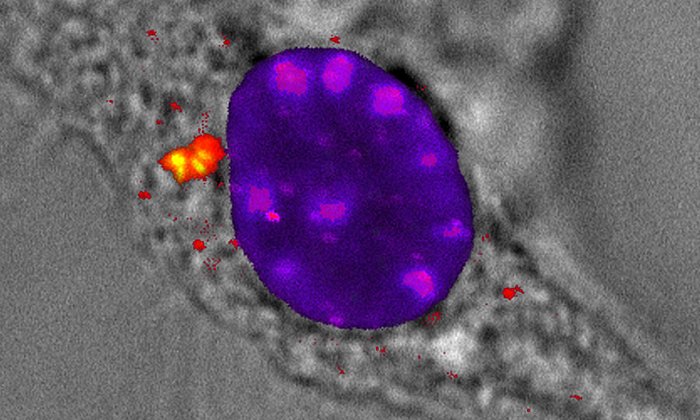
Imiquimod aktiviert das NLRP3-Inflammasom, ein Inflammasom, das auf zellulären Stress und Gewebeschäden reagiert. Olaf Groß und sein Team konnten zeigen, dass NLRP3 aktiviert wird, weil Imiquimod in die Atmungsprozesse der Zellen eingreift. Die Atmungskette ist eine komplexe Reihe biochemischer Reaktionen innerhalb von Mitochondrien, den Kraftwerken der Zelle, an deren Ende das Molekül Adenosintriphosphat, kurz ATP, gebildet wird, dass den Rest der Zelle mit Energie versorgt.
„Durch die Hemmung der Zellatmung wird nicht nur die Produktion von ATP gestoppt, sondern es werden auch Sauerstoffradikale freigesetzt, also giftige Formen von Sauerstoff, die besonders schnell mit anderen Stoffen reagieren", erläutert Dr. Ritu Mishra, eine der beiden Erstautorinnen der Studie. „Imiquimod sorgt dafür, dass besonders viele Radikale freigesetzt werden. Anders als bei anderen Substanzen, die in die Atmungskette eingreifen, aber weniger Radikale erzeugen, wird hier eine Schwelle überschritten, die es möglich macht, dass NLRP3 aktiviert wird.“
Ansatz für Behandlung von inflammatorischen Erkrankungen
„Es herrscht allgemein großes Interesse an der Entwicklung von neue Medikamenten die NLRP3 hemmen und damit Entzündungen unterdrücken“, sagt Dr. Christina J. Groß , ebenfalls Erstautorin der Studie. „Wir hoffen, dass unsere Forschung dazu beiträgt, dass Medikamente entwickelt werden können, die die gefährliche Hyperaktivierung des NLRP3 Inflammasoms verhindern, wie sie bei Erkrankungen wie Gicht oder Multipler Sklerose auftritt.“ Wie sich Imiquimod genau auf Hautkrebszellen auswirkt, und ob die Hemmung der Zellatmung hinter dem Mechanismus der Hemmung des Wachstums von Krebszellen durch die Substanz steht, untersuchen Olaf Groß und sein Team in einer laufenden Nachfolgearbeit. Im Anschluss daran wollen sie neue, mit Imiquimod verwandte chemische Substanzen untersuchen, um herauszufinden, wie sich die verschiedenen Effekte des Medikaments entkoppeln lassen.
Publikation
C.J. Groß, R. Mishra, K.S. Schneider, G. Médard, J. Wettmarshausen, D.C. Dittlein, H. Shi, O. Gorka, P.-A. Koenig, S. Fromm, G. Magnani, T. Ćiković, L. Hartjes, J. Smollich, A.A.B. Robertson, M.A. Cooper, M. Schmidt-Supprian, M. Schuster, K. Schroder, P. Broz, C. Traidl-Hoffmann, B. Beutler, B. Kuster, J. Ruland, S. Schneider, F. Perocchi, O. Groß. "K+ Efflux-Independent NLRP3 Inflammasome Activation by Small Molecules Targeting Mitochondria". Immunity (2016). DOI: http://dx.doi.org/10.1016/j.immuni.2016.08.010
Hochauflösende Bilder
Kontakt
PD Dr. rer. nat. Olaf Groß
Institut für Klinische Chemie und Pathobiochemie Klinikum rechts der Isar
Technische Universität München
+49 89 4140-4874
olaf.gross@tum.de
Technische Universität München
Corporate Communications Center
- Paul Hellmich
- paul.hellmich@tum.de
- presse@tum.de
- Teamwebsite