Forscher entschlüsseln die Fähigkeiten von Riesenzellen des Immunsystems
Gigantische Müllschlucker
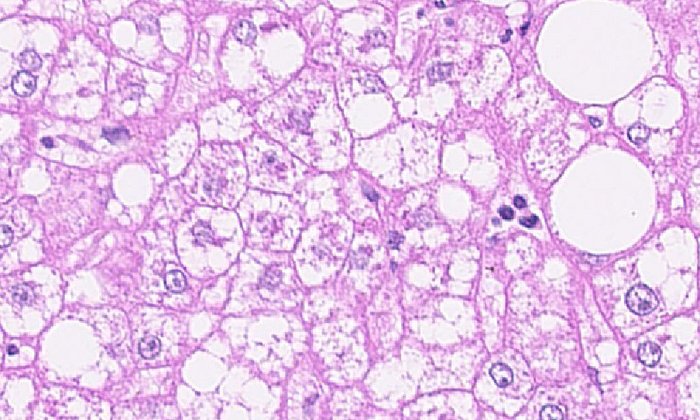
Seit über hundert Jahren kennen Wissenschaftler die riesigen Fresszellen, die „Multinucleated Giant Cells“ (MGCs). Es ist bekannt, dass sie bei bestimmten Erkrankungen wie Tuberkulose, aber auch im Zuge einer Fremdkörperreaktion an Implantaten wie Hüftgelenken auftreten. Ihre genaue Funktion und ihre Wirkmechanismen wurden jedoch bisher nicht systematisch erforscht. „Weil sie so riesig sind und durch Fusion einzelner Fresszellen entstehen, wurde schon lange vermutet, dass sie als spezielles Entsorgungssystem für große Abfälle dienen“, sagt Dr. Admar Verschoor, Coautor der Studie und Gruppenleiter am Institut für Medizinische Mikrobiologie, Immunologie und Hygiene der TUM.
Systemische Amyloidose als Modellsystem
Um die Funktion der Riesenzellen aufzuklären, konzentrierten sich er und sein Team neben aufwendigen und richtungsgebenden Zellkultur-Experimenten auf die Krankheit systemische Amyloidose. Hier sammeln sich aufgrund von Defekten große Proteinklumpen in den Zellzwischenräumen an. Sie schädigen das umliegende Gewebe und stören nach und nach die Funktion des betroffenen Organs wie zum Beispiel der Leber oder der Milz. So schloss sich das Team mit Mark B. Pepys, einem der führenden Experten auf dem Gebiet der Amyloidose-Forschung, vom University College London zusammen. Die britische Forschungsgruppe hatte bereits in ersten klinischen Studien ein neues Medikament gegen die Krankheit – einen therapeutischen Antikörper – erfolgreich getestet.
„Es gab verschiedene Hinweise, aber der genaue Wirkmechanismus des Medikaments war bisher noch unklar – hier konnten wir unser Fachwissen über Fresszellen und das Immunsystem einbringen und gleichzeitig die Funktion der Riesenzellen genauer untersuchen“, sagt Ronny Milde, Erstautor der Studie und Wissenschaftler an der TUM. In Zellkultur- und Krankheitsmodellen konnten die Wissenschaftler schließlich den Wirkmechanismus aufklären: Das Medikament führt dazu, dass die störenden Proteinklumpen vom Immunsystem durch Andocken von speziellen Molekülen markiert und dadurch von den Riesenzellen erkannt werden. Verantwortlich ist dafür das so genannte Komplementsystem.
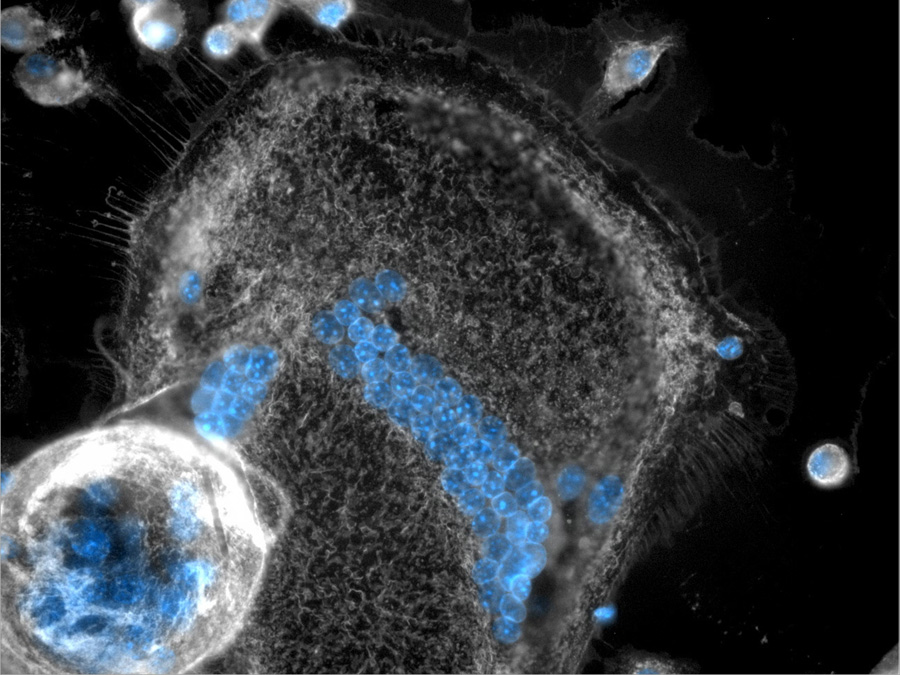
Riesenzellen entsorgen zellulären „Sperrmüll“
„Das Komplementsystem funktioniert ein bisschen wie die Butter auf unserem Brot. Schmieren wir Butter auf das Brot, greifen wir lieber zu, weil es besser schmeckt. Das neue Medikament aktiviert das Komplementsystem und wirkt somit wie die Butter – die Proteinklumpen werden für die Riesenfresszellen dadurch erst interessant“, erklärt Admar Verschoor.
Die Wissenschaftler konnten im Mikroskop anschließend auch beobachten, dass die Fresszellen die Proteinklumpen umschlossen und abbauten. „Durch unsere Studien konnten wir den Beweis liefern, dass die Riesenzellen besonders geeignet sind als Entsorgungssystem für Komplement-markierte Großabfälle und somit maßgeblich zum Therapieerfolg bei systemischer Amyloidose beitragen“, ergänzt Verschoor.
Download Bildmaterial
Publikation
Ronny Milde, Julia Ritter, Glenys A. Tennent, Andrzej Loesch, Fernando O. Martinez, Siamon Gordon, Mark B. Pepys, Admar Verschoor, Laura Helming, Multinucleated giant cells are specialized for complement-mediated phagocytosis and large target destruction, Cell Reports, November 2015.
DOI: 10.1016/j.celrep.2015.10.065
Kontakt
Admar Verschoor, PhD
Institut für Medizinische Mikrobiologie, Immunologie und Hygiene
Klinikum rechts der Isar der Technischen Universität München
Tel.: +49 89 4140-6720
admar.verschoor@tum.de
www.mikrobio.med.tum.de/node/32
Technische Universität München
Corporate Communications Center
- Dr. Vera Siegler
- vera.siegler@tum.de
- presse@tum.de
- Teamwebsite