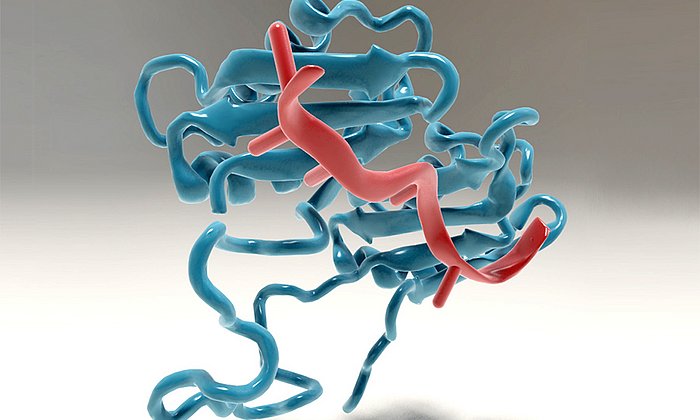
Strukturbiologie entwickelt Wirkstoff, der Trypanosomen blockiert
Neues Medikament gegen die Schlafkrankheit
Bohrkörper, so heißen Trypanosomen aus dem Griechischen übersetzt. Die einzelligen Parasiten sind für verschiedene schwere Erkrankungen vor allem in Lateinamerika und Afrika verantwortlich.
Berühmtestes Beispiel ist wohl die von Trypanosomen ausgelöste Schlafkrankheit, die durch die Tsetse-Fliege übertragen wird. In ihrem Endstadium fallen die Patienten in einen Dämmerzustand, der der Krankheit ihren Namen verliehen hat.
Ein weiteres Beispiel ist die sogenannte Chagas-Krankheit, die von Trypanosoma cruzi ausgelöst und von Raubwanzen übertragen wird. Schätzungen zufolge sind auf dem amerikanischen Kontinent rund acht Million Menschen davon betroffen. Symptome sind unter anderem Herzbeschwerden aber auch Nervenschäden im Verdauungstrakt.In der Studie wurde stellvertretend Trypanosoma cruzi untersucht.
„Gegen Trypanosomen gibt es bisher nur wenige Medikamente, die noch dazu viele Nebenwirkungen haben, und es breiten sich bereits erste Resistenzen aus“, erklärt Prof. Michael Sattler, Direktor des Instituts für Strukturbiologie am Helmholtz Zentrum München und Inhaber des Lehrstuhls für Biomolekulare NMR Spektroskopie an der TU München.
Gemeinsam mit Dr. Grzegorz Popowicz (ebenfalls Helmholtz Zentrum München) und der Arbeitsgruppe von Prof. Ralf Erdmann an der Ruhr-Universität Bochum suchte das Forschungsteam nach neuen Möglichkeiten, den Erreger auszuschalten. „Wir konzentrierten uns dabei vor allem auf die sogenannten PEX-Proteine, die schon länger als mögliche Zielstrukturen diskutiert wurden“, so Sattler.
Pex und hopp!
Die PEX-Proteine spielen eine entscheidende Rolle für die Funktion der sogenannten Glykosomen. Das sind kleine Zellorganellen, die der Parasit für seinen Zuckerstoffwechsel benötigt. „Die Idee war, das Zusammenspiel der beiden wichtigen Proteine PEX14 und PEX5 zu verhindern und dadurch den Stoffwechsel der Trypanosomen so massiv zu stören, dass sie nicht überleben können“, erklärt Grzegorz Popowicz.
Am Bayerischen NMR-Zentrum, das gemeinsam vom Helmholtz Zentrum und der TU München betrieben wird, untersuchten die Forscher daher zunächst mit Hilfe der Kernspinresonanz (engl.: nuclear magnetic resonance, NMR)-Spektroskopie die Struktur der beiden Zielproteine.
Im nächsten Schritt optimierten die Teams aus München und Bochum dann anhand der nun bekannten räumlichen Struktur einen Wirkstoff, der perfekt an PEX14 bindet, so die Wechselwirkung mit PEX5 verhindert und die Parasiten abtötet. Grzegorz Popowicz beschreibt es so: „Wir haben quasi zunächst das Schloss vermessen und anschließend den Schlüssel dafür entworfen.“
Möglicherweise auch bei anderen Parasiten relevant
Künftig wollen die Forscher die Moleküle weiterentwickeln, damit sie in klinischen Studien getestet und gegebenenfalls zur Herstellung von Medikamenten genutzt werden können. Darüber hinaus untersuchen sie, inwiefern sich die Methode auch für den Einsatz bei anderen einzelligen Parasiten anbietet, die möglicherweise auf ähnliche Proteine angewiesen sind. „Denkbar wäre hier etwa die Bekämpfung von Leishmanien“, erklärt Popowicz. In diese Richtung werde man künftig weiterforschen.
Die Arbeiten wurde gefördert mit Mitteln der Europäischen Union aus dem Marie Skłodowska-Curie-Programm, durch die Deutsche Forschungsgemeinschaft (u.a. über den Exzellenzcluster Center for Integrated Protein Science Munich), die Helmholtz-Gemeinschaft, das Wrocław Centre of Biotechnology und das Ministerium für Bildung, Jugend und Sport der Tschechischen Republik. Röntgenstrukturanalysen wurden an der European Synchrotron Radiation Facility (ESRF) in Grenoble (Frankreich) durchgeführt, die NMR-Messungen am Bayerischen NMR-Zentrum in Garching. An der Forschungsarbeit waren darüber hinaus das Central European Institute of Technology der Masaryk University (Brno, Tschechische Republik), das Schweizerisches Tropen und Public Health Institut (Basel, Schweiz), die Universität Basel sowie die School of Medicine der New York University (New York, USA) beteiligt.
Publikation:
Inhibitors of PEX14 disrupt protein import into glycosomes and kill Trypanosoma parasites
M. Dawidowski, L. Emmanouilidis, V. C. Kalel, K. Tripsianes, K. Schorpp, K. Hadian, M. Kaiser, P. Mäser, M. Kolonko, S. Tanghe, A. Rodriguez, W. Schliebs, R. Erdmann, M. Sattler, G. M. Popowicz
Science, March 31, 2017 – DOI: 10.1126/science.aal1807
Kontakt:
Prof. Dr. Michael Sattler
Technische Universität München
Lehrstuhl für Biomolekulare NMR-Spektroskopie
Lichtenbergstr. 4, 85748 Garching, Germany
Tel.: +49 89 289 13418 – E-Mail – Web
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite