Designte Peptide als mögliche Hemmstoffe gegen Amyloidplaques
Alzheimer und Diabetes: Hoffnung auf Hemmstoffe gegen Amyloidplaques
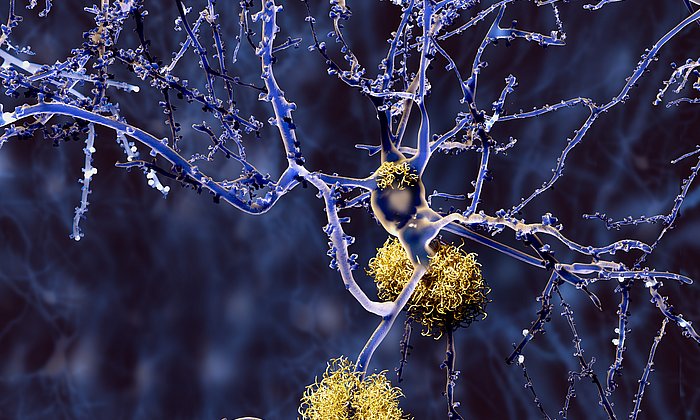
Eiweißablagerungen, die so genannten Amyloidplaques, begünstigen Alzheimer und Typ 2 Diabetes. Diese Plaque-Bildung im menschlichen Gehirn zu verhindern oder zu hemmen, daran forschen mehrere Wissenschaftlerteams weltweit.
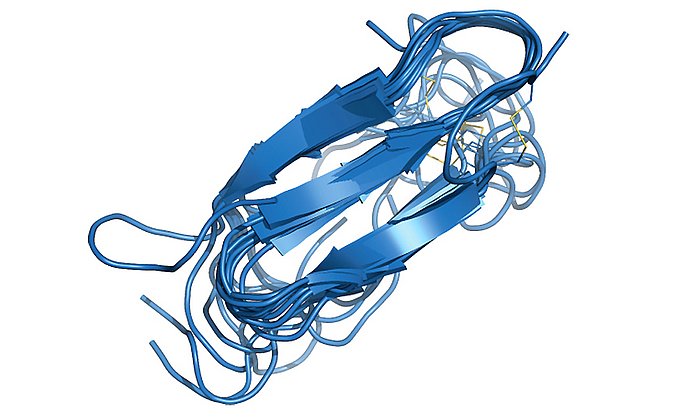
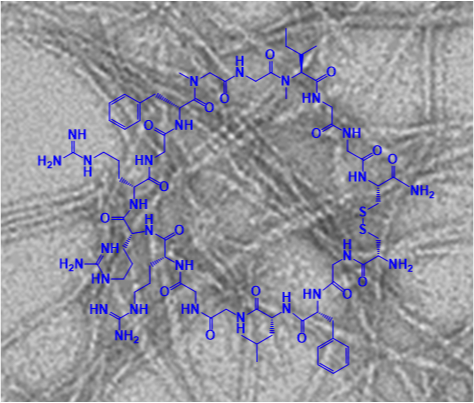
An einer Idee hat auch das interdisziplinäre Team um Aphrodite Kapurniotu, Professorin für Peptidbiochemie (TUM) am Wissenschaftszentrum Weihenstephan zusammen mit Forschern um Professor Martin Zacharias (TUM), Professor Gerhard Rammes (TUM Klinikum rechts der Isar) und Professor Jürgen Bernhagen (Institut für Schlaganfall und Demenzforschung (ISD) der Ludwig-Maximilians-Universität (LMU)) seit einiger Zeit geforscht und präsentiert nun makrozyklische Peptide (MCIPs), die für eine Amyloid-Hemmung infrage kommen. Über Ihre Ergebnisse berichten die Forscher in der Fachzeitschrift „Angewandte Chemie“.
Neue Klasse von Amyloid-Hemmstoffen
In seiner neuen Studie präsentiert das Team makrozyklische Peptide, die als eine neue Klasse von Amyloid-Hemmstoffen entwickelt wurden. „Dabei haben wir ein MCIP entdeckt, welches im menschlichen Blutplasma stabil ist und außerdem die menschliche Blut-Hirn-Schranke im Zellmodell überwinden kann", erklärt Professorin Kapurniotu – „zwar konnten wir diese Eigenschaften bislang „nur“ im Reagenzglas nachweisen – es ist also noch weitere Forschung nötig. Aber das wären zwei sehr wünschenswerte Eigenschaften für Alzheimerplaque-Hemmstoffe."
Ein Patent auf die neu-entwickelten makrozyklischen Peptide ist von der TUM bereits angemeldet worden. „Sie könnten eine gute Alternative zu aktuell verfolgten Antikörper-basierten Ansätzen als Therapeutika gegen Alzheimerplaque-Bildung werden, weil sie leicht herstellbar sind, vielversprechende Eigenschaften besitzen und als Peptidwirkstoffe deutlich preiswerter als Antikörper sein werden", sagt Professorin Kapurniotu.
„Daher sind nun weitere Untersuchungen geplant, um zu überprüfen, ob die MCIPs auch in in-vivo Modellen wirksam sind. Weiterhin könnten sich die MCIPs auch als Grundgerüste für die Entwicklung von kleinmolekularen Peptidomimetika (chemische Verbindungen, die einem Peptid nachempfunden sind) als Anti-Amyloidplaque Therapeutika bei Alzheimer und Typ 2 Diabetes eignen“.
Weitere Informationen:
Die Forschungsarbeiten wurden von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des SFB 1035 gefördert.
Publikation:
Anna Spanopoulou, Luzia Heidrich, Hong‐Ru Chen, Christina Frost, Dean Hrle, Eleni Malideli, Kathleen Hille, Alexandros Grammatikopoulos, Jürgen Bernhagen, Martin Zacharias, Gerhard Rammes and Aphrodite Kapurniotu: Designed Macrocyclic Peptides as Nanomolar Amyloid Inhibitors Based on Minimal Recognition Elements, Angew Chem Int Ed Engl. 06/2018. DOI: 10.1002/anie.201802979.
Kontakt:
Prof. Dr. Aphrodite Kapurniotu
Technische Universität München
Professur für Peptidbiochemie
Tel: 08161-713542
E-Mail: akapurniotu@wzw.tum.de
Technische Universität München
Corporate Communications Center
- Sabine Letz
- letz@zv.tum.de
- presse@tum.de
- Teamwebsite