Chaperone erkennen unfertige Signalmoleküle im Immunsystem
Qualitätskontrolle in der Immunkommunikation
Gelangen Krankheitserreger in den Organismus, muss die körpereigene Abwehr rasch reagieren. Die Eindringlinge werden von den weißen Blutkörperchen identifiziert; diese geben die Information an andere Immunzellen weiter. Dazu schütten sie Interleukine – komplexe Signalproteine – aus, die an passende Rezeptoren in den Empfängerzellen andocken und diese Zellen zum Beispiel dazu bringen, sich intensiv zu vermehren und Abwehrmoleküle freizusetzen.
Qualitätskontrolle hält unfertige Moleküle fest
Forscher und Forscherinnen der TUM, des Helmholtz Zentrums München und der Universität Stanford haben nun am Beispiel von Interleukin 23 gezeigt, wie die Zellen dafür sorgen, dass die Interleukin-Signalproteine korrekt aufgebaut werden. „Interleukin 23 steht zurzeit im Mittelpunkt intensiver Forschung, weil es nicht nur eine große Rolle bei der Abwehr von Krankheitserregern spielt, sondern auch selbst Autoimmunkrankheiten auslösen kann,“ erklärt Matthias Feige, Professor für Zelluläre Proteinbiochemie an der TUM und Leiter des Forschungsprojekts.
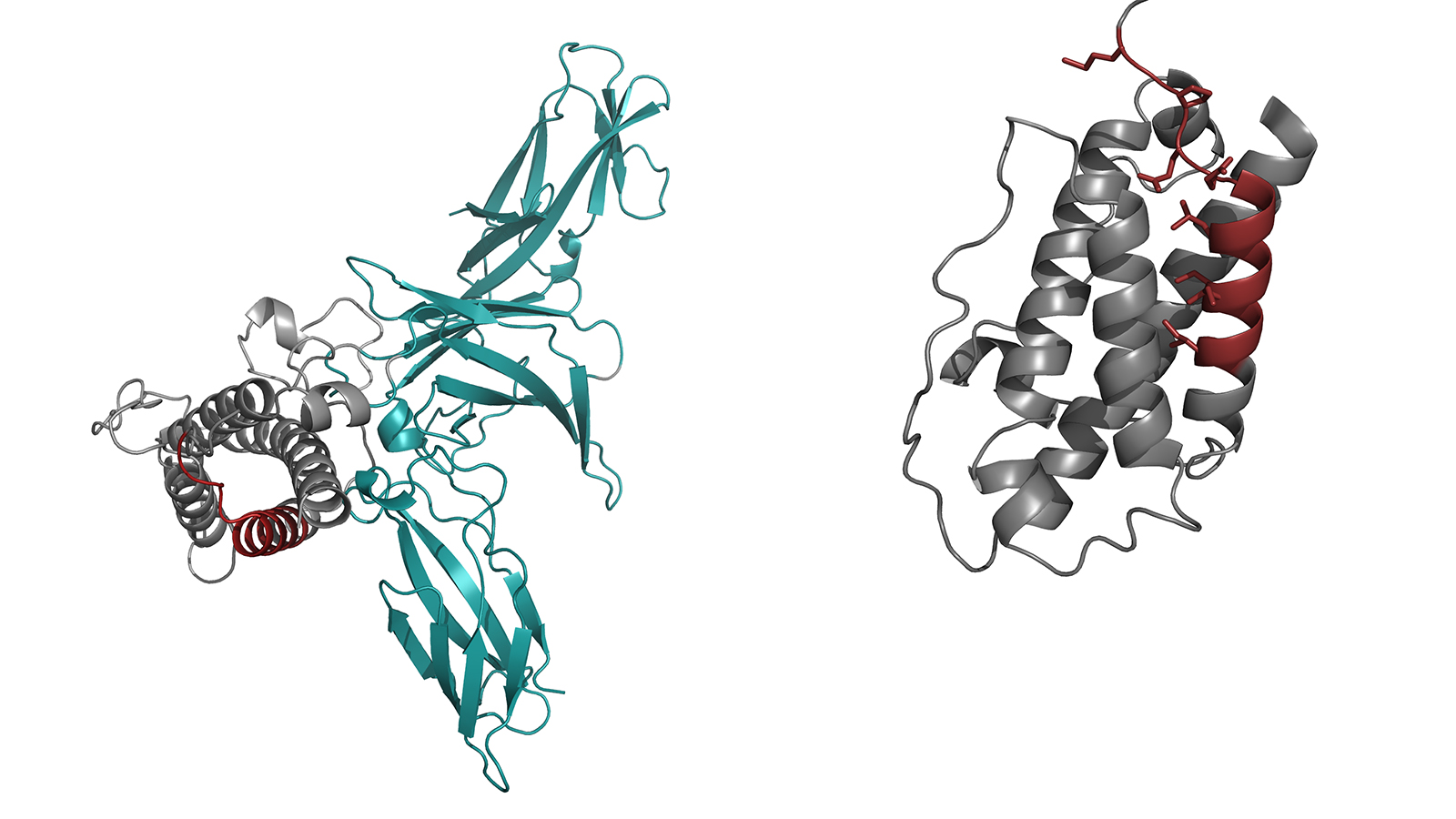
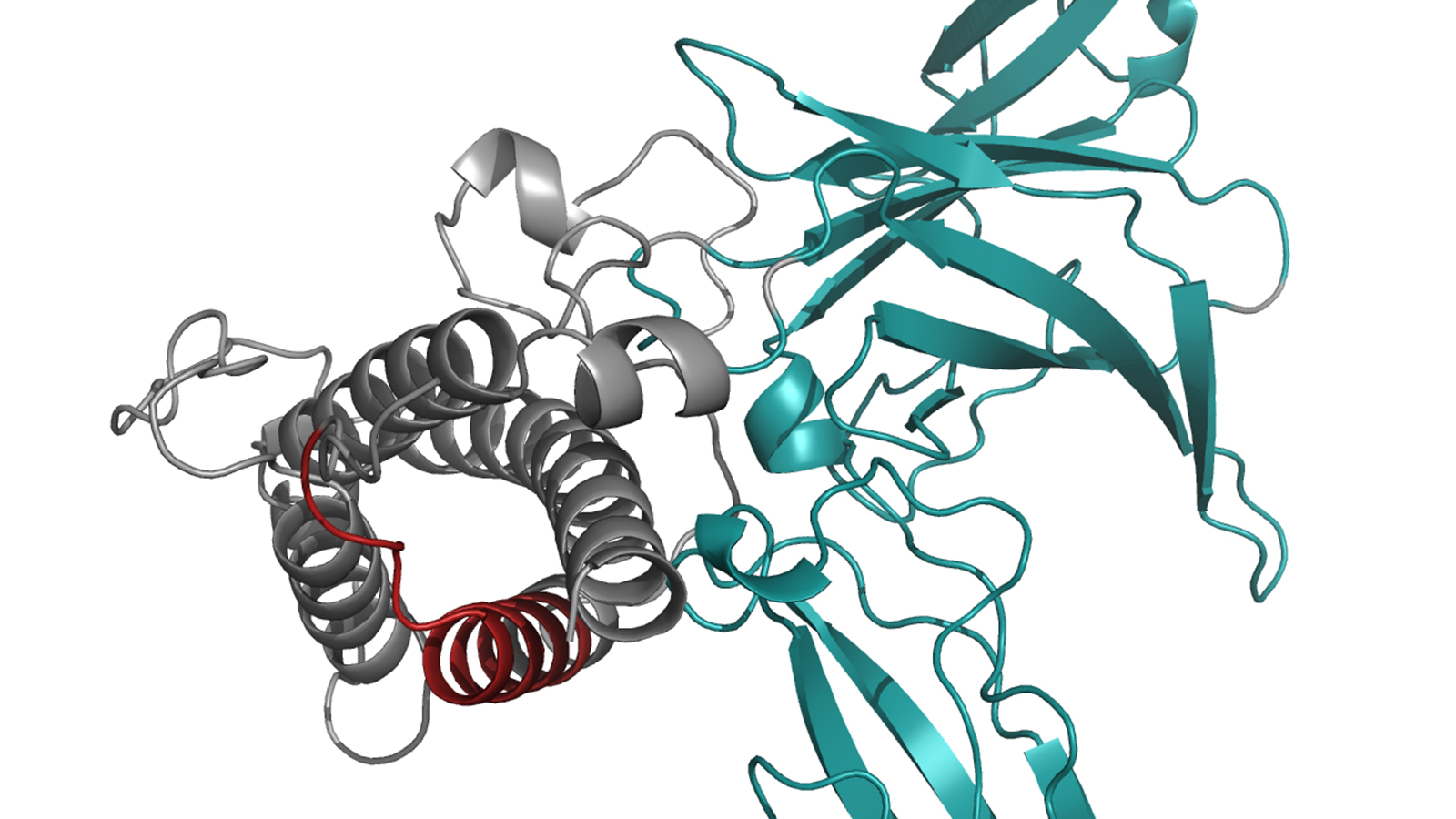
Interleukin 23 besteht aus zwei Proteinen, die sich in der Zelle zu einem aktiven Komplex verbinden müssen, um die gewünschten Signale auslösen zu können. Wie die Wissenschaftler und Wissenschaftlerinnen gezeigt haben, halten sogenannte Chaperone den mit IL23-alpha bezeichneten Teil des Interleukins so lange in der Zelle fest, bis er in den vollständigen Komplex eingebaut ist. So stellt die Zelle sicher, dass sie kein unverbundenes IL23-alpha abgibt, und steuert damit die Biosynthese dieses wichtigen Interleukins. Chaperone sind selbst Proteinmoleküle – molekulare Maschinen – die dafür sorgen, dass andere Proteine korrekt aufgebaut werden.
„Wir konnten zeigen, dass das unverbundene IL23-alpha gewissermaßen offene chemische Bindungen hat, an die das Chaperon andocken kann,“ erläutert Feige. Im vollständigen Interleukin 23 sind diese Bindungen geschlossen, sodass das Chaperon keinen Angriffspunkt mehr findet und das Gesamtmolekül die Zelle verlassen kann.
Gezielt in die Immunzellkommunikation eingreifen
Da das IL23-alpha alleine nicht außerhalb der Zellen auftritt, war unklar, ob es selbst auch das Immunsystem beeinflussen kann. Das konnten die Forscherinnen und Forscher mit einer geringfügig modifizierten Version des Moleküls überprüfen, die sie zunächst am Computer entworfen und anschließend im Labor hergestellt haben. In dieser neuen Molekülvariante waren die Bindungen, an die das Chaperon hätte binden können, geschlossen.
„Die veränderten Moleküle können die Zelle ungehindert verlassen“, sagt Susanne Meier, Erstautorin der Studie. „Sie binden dann an dieselben Rezeptoren wie das vollständige Interleukin 23 und lösen dort eine ähnliche Reaktion aus – wenn auch in abgeschwächter Form.“ IL23-alpha kann demnach auch als Signalmolekül fungieren, wenn man es mit molekularem Engineering verändert und so die Qualitätskontrolle in der Zelle umgeht.
„Es ist möglich, dass die modifizierten Moleküle noch an weitere Rezeptoren in Immunzellen binden und diese in einer noch unbekannten Weise beeinflussen“, erklärt Feige. „Das wollen wir als nächstes untersuchen“. Die Ergebnisse könnten Grundlage von Medikamenten werden, die mit modifizierten Interleukinen gezielt in das Immunsystem eingreifen.
S. Meier, S. Bohnacker, C. J. Klose, A. Lopez, C. A. Choe, Ph. W.N. Schmid, N. Bloemeke, F. Rührnößl, M. Haslbeck, J. Esser-von Bieren, M. Sattler, Po-Ssu Huang & M. J. Feige. “The molecular basis of chaperone-mediated interleukin 23 assembly control”. Nature Communications 10, 4121 (2019); DOI: 10.1038/s41467-019-12006-x
- Die Professur von Matthias Feige wird über das Institute of Advanced Study der TUM und das Marie Curie COFUND Programm aus Mitteln der Exzellenzinitiative des Bundes und der Länder und des Siebten Forschungsrahmenprogramms der Europäischen Union finanziert. Die Arbeiten wurden im Rahmen des Sonderforschungsbereichs 1035 „Kontrolle von Proteinfunktion durch konformationelles Schalten“ durchgeführt.
- Wesentlich an dem Projekt beteiligt waren Forschende des Zentrums für Allergie und Umwelt (ZAUM). Untersuchungen zur Struktur und Wechselwirkung der Proteine wurden am Bayerischen NMR-Zentrum durchgeführt. Beides sind gemeinsame Einrichtungen der TUM und des Helmholtz Zentrums München.
- Die Abbildung der Proteinstruktur beruht auf Ergebnissen, die im folgenden Artikel veröffentlicht wurden:
Lupardus, P. J. & Garcia, K. C. „The structure of interleukin-23 reveals the molecular basis of p40 subunit sharing with interleukin-12“. J. Mol. Biol. 382, 931–941 (2008) doi: 10.1016/j.jmb.2008.07.051
Die Daten sind unter der Identifikation 3DUH in der Protein Data Base zugänglich.
Hochauflösende Bilder für die redaktionelle Berichterstattung:
Kontakte zum Artikel:
Prof. Dr. Matthias Feige
Technische Universität München
Professur für Zelluläre Proteinbiochemie
Tel.:+49(0)89 289 13667
matthias.feige(at)tum.de