Simulation des Enzyms AsqJ zeigt neue Optionen für Wirkstoffherstellung
Die Enzymdesigner

Ohne Enzyme käme die Natur zum Stillstand. Die winzigen Moleküle beschleunigen biochemische Reaktionen oder machen sie überhaupt erst möglich. Doch was geschieht dabei im Detail? „Die genaue Funktion von Enzymen zu verstehen ist eine der größten Herausforderungen der modernen Biochemie“, sagt Ville Kaila, Professor für Computergestützte Biokatalyse an der TU München.
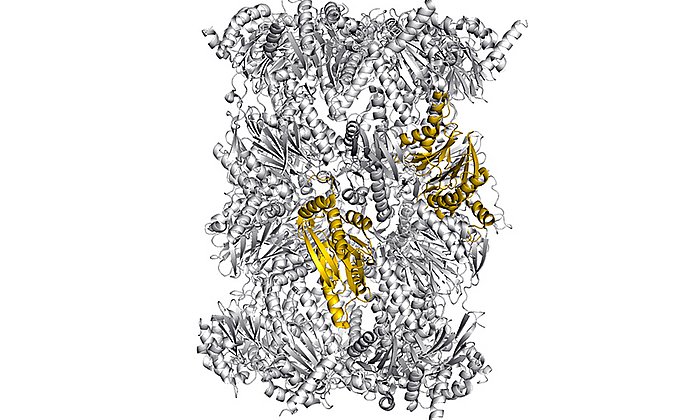
Ein Forschungsteam um Ville Kaila und Michael Groll, Professor für Biochemie an der TU München, entschlüsselte jetzt erstmals den Mechanismus des Enzyms AsqJ (Aspoquinolone J), einer Dioxygenase, die Sauerstoff für die Aktivierung von Kohlenstoffbindungen benutzt.
Ein Enzym – viele Reaktionen
Das Enzym AsqJ ist ein besonders spannender Kandidat für die Wissenschaft, weil es eine Kaskade chemischer Reaktionen katalysiert, die schließlich zur Bildung antibakterieller Wirkstoffe führt. Erst vor wenigen Jahren wurde es im Schimmelpilz Aspergillus nidulans entdeckt.
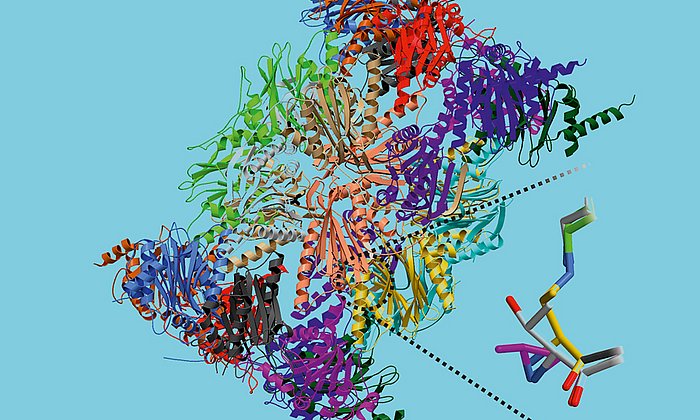
Um das Geheimnis des Enzyms zu lüften, kombinierten die Forschenden verschiedene Methoden: Im ersten Schritt ermittelten Alois Bräuer und Prof. Michael Groll mit Hilfe der Röntgenkristallographie die dreidimensionale atomare Struktur des Moleküls. Diese nutzten Erstautorin Sophie L. Mader und Ville Kaila im nächsten Schritt für die quantenmechanische Simulation der biochemischen Prozesse.
Mit Simulationen dem Geheimnis auf der Spur
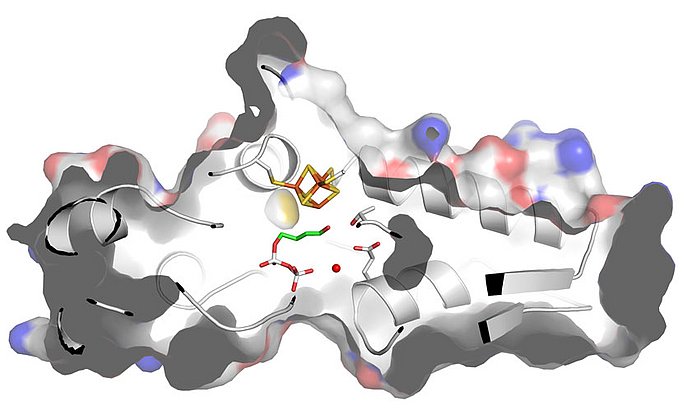
„Unsere Berechnungen zeigen, wie das Enzym die Bildung antibakterieller Wirkstoffe, der Chinolon-Alkaloiden, katalysiert“, berichtet Kaila. „Erstaunlich ist dabei, welche Rolle winzige Details spielen: Eine geringfügige Veränderung des Substrats, nämlich die Entfernung einer kleinen Atomgruppe, bringt die Reaktion bereits zum Erliegen.“
Als nächstes simulierten das Team am Computer eine neue Variante des Enzyms, die auch mit dem veränderten Substrat die Bildung der Chinolon-Alkaloide katalysiert. Dieses neue Enzym wurde mit Hilfe von Bakterienkulturen hergestellt und auf seine Funktion getestet. „Das Ergebnis war beeindruckend: Schon nach wenigen Sekunden setzte die erwartete Reaktion ein“, erinnert sich Bräuer.
Computerdesign für neue Wirkstoffe
„Das Experiment zeigt, dass unsere Methode funktioniert und geeignet ist, auch die Funktion anderer Enzyme auf molekularem Niveau darzustellen“, so der Wissenschaftler. Noch sei das Enzym-Design Grundlagenforschung – diese habe jedoch ein enormes Potenzial. Ein Ziel künftiger Forschung werde es sein, Enzyme am Computer zu entwerfen, beispielsweise für die Produktion von Medikamenten.
Publikation:
S. L. Mader, A. Bräuer, M. Groll, V. R. I. Kaila
Catalytic mechanism and molecular engineering of quinolone biosynthesis in dioxygenase AsqJ. Nature Communications 9(1), 1168 (2018) – DOI: 10.1038/s41467-018-03442-2
Mehr Informationen:
Die Arbeit wurde gefördert vom European Research Council (ERC), von der Deutschen Forschungsgemeinschaft (DFG) über die Sonderforschungsbereiche SFB 1035 und SFB 749 sowie im Rahmen des Exzellenzclusters Integrated Protein Science Munich (CIPSM). Weitere Unterstützung erhielt das Projekt im Rahmen der Forschungskooperation zwischen der TUM und der King Abdullah University of Science and Technology (KAUST). Die Kristallstrukturen wurden in Kooperation mit der Synchrotronquelle des Paul Scherrer Instituts in Villigen (Schweiz) ermittelt. Die Computersimulationen wurden in Kooperation mit dem Leibniz-Rechenzentrum der Bayerischen Akademie der Wissenschaften durchgeführt.
Kontakt:
Prof. Dr. Ville R. I. Kaila
Technische Universität München
Professur für Computergestützte Biokatalyse
Tel.: +49 89 289 13612
ville.kaila@ch.tum.de
Hochauflösende Bilder:
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite