Transportproteine können zwischen Mikrotubuli- und Aktin-Netzwerk wechseln
Spurwechsel im Zellskelett

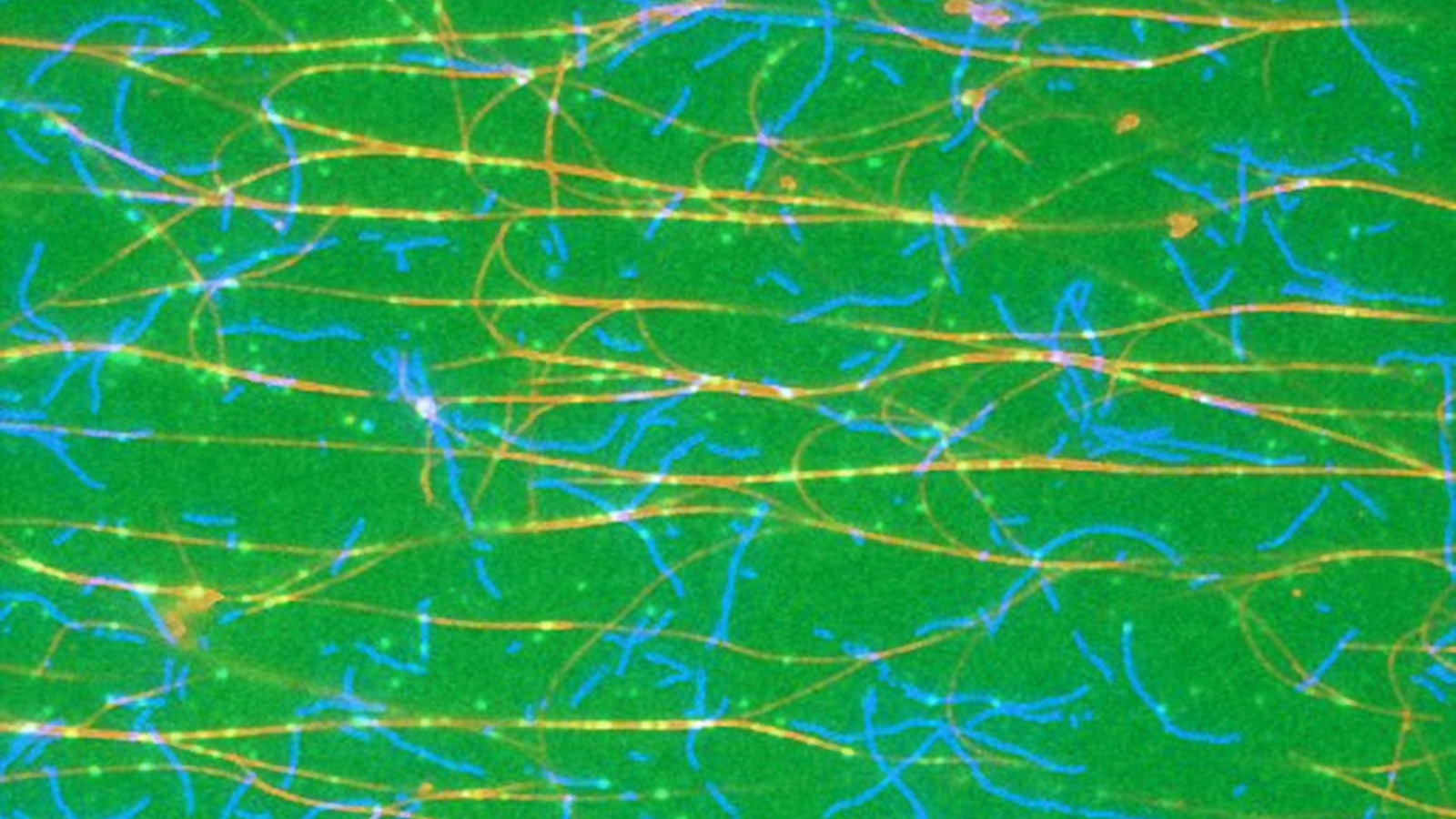
Alle Zellen höherer Organismen sind von einem Zellskelett durchzogen, das im Wesentlichen aus Aktin-Filamenten und kleinen Proteinröhren, den Mikrotubuli, besteht. Lange Zeit betrachtete die Wissenschaft die Aktin- beziehungsweise Mikrotubuli-Netzwerke als unabhängige Systeme.
Heute weiß man, dass die beiden Netzwerk-Typen miteinander kommunizieren und damit lebenswichtige zelluläre Prozesse wie die Zellteilung oder die Zellmigration überhaupt erst möglich machen. Wie diese Zusammenarbeit auf molekularer Ebene funktioniert, war allerdings noch unbekannt.
Dr. Zeynep Ökten vom Lehrstuhl für Molekulare Biophysik der Technischen Universität München (TUM) und Erwin Frey, Professor für Statistische und Biologische Physik der Ludwig-Maximilians-Universität München, haben mit ihren Teams nun am Beispiel des Farbwechsels bei Tieren erstmals einen Mechanismus identifiziert, der die Kommunikation zwischen beiden Netzwerksystemen erklärt und potenzielle Evolutionswege aufgedeckt.
Transportwege in der Zelle
Viele funktionelle Bestandteile einer Zelle, etwa die Organellen, müssen in der Zelle zum richtigen Zeitpunkt an den richtigen Ort gebracht werden. Dazu werden sie von molekularen Motoren auf den Mikrotubuli und Aktinfilamenten transportiert.
Motoren, die lange als spezifisch für eines der beiden Netzwerksysteme galten, können aber in Wirklichkeit auch auf den anderen Filamenttyp umgelenkt werden. In Mäusen etwa wurde ein Adapter-Protein gefunden, das diese Umlenkung möglich macht.
Myosin transportiert seine Fracht über das Aktin-Netzwerk. Das Adapter-Protein interagiert aber auch mit den Mikrotubuli und kann den Transport auf dieses Netzwerk umleiten. Welches Netzwerk präferiert wird, steuert eine chemische Modifikation an einer bestimmten Bindungsstelle des Adapter-Proteins.
Adapter-Protein mit Umschalt-Modus
Ein dem Säugetier-Adapter entsprechendes Protein weisen auch Fische und Amphibien auf. Die evolutiv älteren Fische und Amphibien nutzen es, um Pigment-Organellen innerhalb spezieller Zellen umzuverteilen und können so ihre Hautfarbe an Umweltfaktoren anpassen.
Daher setzte das Forschungsteam für experimentelle Untersuchungen in Öktens Labor Zebrafische und Krallenfrösche ein, um den Ursprung und die molekularen Mechanismen der Interaktion zwischen dem Mikrotubuli- und dem Aktin-Netzwerk zu untersuchen.
Evolution eines molekularen Schalters
Dabei fanden die Wissenschaftler, dass sowohl das Maus- als auch das Krallenfrosch-Adapter-Protein eine bestimmte Domäne besitzt, die das Umschalten zwischen Aktin- und Mikrotubuli-Transport ermöglicht.
Zebrafische, die evolutiv ältesten der untersuchten Tiere, haben diese Domäne noch nicht. „Hier unterliegen die Motorproteine, die die Pigmente bewegen, anderen Regulationsmechanismen und es gibt noch keine Interaktion zwischen den verschiedenen Zellskelett-Netzwerken“, sagt Ökten.
„Bei den Krallenfröschen dagegen ist das Umschalten zwischen den Netzwerken zwingend erforderlich, damit das Tier sich umfärben kann – und diese Fähigkeit zum Umschalten hat sich auch im weiteren Verlauf der Evolution vom Amphibium zum höheren Wirbeltier erhalten“, erläutert Ökten weiter.
Theoretisches Modell erklärt Pigmentumverteilung
Die experimentellen Ergebnisse zeigten, dass die Umweltsignale, die im Organismus von Krallenfröschen eine Umverteilung der Pigment-Organellen bewirken, mit einer Änderung der Wahrscheinlichkeit zusammenhängen, mit der einzelne Motorproteine von den Aktin- zu den Mikrotubuli-Filamenten wechseln.
„Wir haben ein theoretisches Modell entwickelt, das die Umschaltwahrscheinlichkeit eines einzelnen Motorproteins mit der zellweiten Umverteilung der Pigment-Organellen in Beziehung setzt“, sagt Frey. Die Computersimulationen ergaben, dass tatsächlich die Variation der Umschaltwahrscheinlichkeit als einziger Parameter ausreicht, um eine Umverteilung der Organellen in den simulierten Zellen zu provozieren.
Molecular Underpinnings of Cytoskeletal Crosstalk
Angela Oberhofer, Emanuel Reithmann, Peter Spieler, Willi L. Stepp, Dennis Zimmermann, Bettina Schmid, Erwin Frey and Zeynep Ökten, PNAS 10.02.2020 – DOI: 0.1073/pnas.1917964117
Die Forschungsarbeit wurde durch das European Research Council (ERC) und die Deutsche Forschungsgemeinschaft (DFG) gefördert.
Technische Universität München
Corporate Communications Center
- Dr. Andreas Battenberg
- battenberg@zv.tum.de
- presse@tum.de
- Teamwebsite
Kontakte zum Artikel:
Dr. Zeynep Ökten
Molekulare Biophysik
Technische Universität München
Tel.: +49 89 289 12885
zoekten@ph.tum.de
Prof. Dr. Erwin Frey
Statistische und Biologische Physik
Arnold-Sommerfeld Center für Theoretische Physik
Ludwig-Maximilians-Universität München
Tel.: +49 89 2180 4538
erwin.frey@physik.lmu.de