Bildgebung: Neuer Sensor misst Kalziumkonzentration tief in lebendem Gewebe
Sichtbare Signale aus Hirn und Herz
Kalzium ist ein wichtiger Botenstoff in unserem Körper. In Nervenzellen entscheiden Kalziumionen zum Beispiel darüber, ob Signale an andere Nervenzellen weitergegeben werden oder nicht. Ob ein Muskel angespannt oder entspannt ist, hängt ebenfalls von der Menge an Kalzium in den Muskelzellen ab. Das gilt auch für unseren wichtigsten Muskel – dem Herz.
„Weil Kalzium für essentielle Organe wie Herz und Gehirn eine so entscheidende Rolle spielt, würde man gerne ‚live‘ und tief im Gewebe beobachten können, wie sich Kalziumkonzentrationen verändern – auch um fehlgesteuerte Prozesse bei Krankheiten besser zu verstehen. Unser neues Sensormolekül ist ein kleiner erster Schritt in diese Richtung.“, sagt Prof. Gil Gregor Westmeyer, Leiter der Studie und Professor für Molekulare Bildgebung an der TUM, sowie Forschungsgruppenleiter am Helmholtz Zentrum München. An den Arbeiten, die im „Journal of the American Chemical Society“ veröffentlicht wurden, war auch Prof. Thorsten Bach von der TUM Fakultät für Chemie beteiligt. Die Forscher konnten ihr Molekül bereits in Herzgewebe und Gehirnen von lebenden Zebrafischlarven erfolgreich testen.
Kalzium-Messung auch in tieferen Gewebeschichten möglich
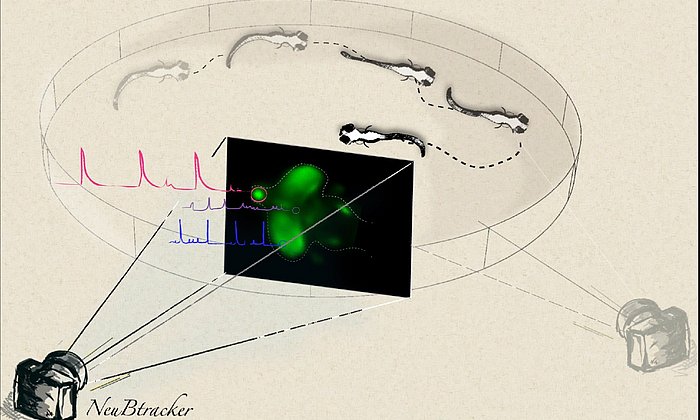
Um den Sensor auch in lebenden Tieren und später vielleicht auch im Menschen nutzbar zu machen, ist er mit einem recht neuen, nicht-invasivem bildgebenden Verfahren messbar: der Optoakustik. Diese Bildgebungsmethode beruht auf der für den Menschen ungefährlichen Ultraschalltechnik und kommt ohne radioaktive Strahlung aus. Dabei erwärmen Laserimpulse die absorbierenden Sensormoleküle im Gewebe und dehnen sie kurzzeitig aus, so dass in der Folge Ultraschallsignale erzeugt werden. Diese erfassen die Wissenschaftler dann mit entsprechenden Detektoren und ‚übersetzen‘ sie in dreidimensionale Bilder.
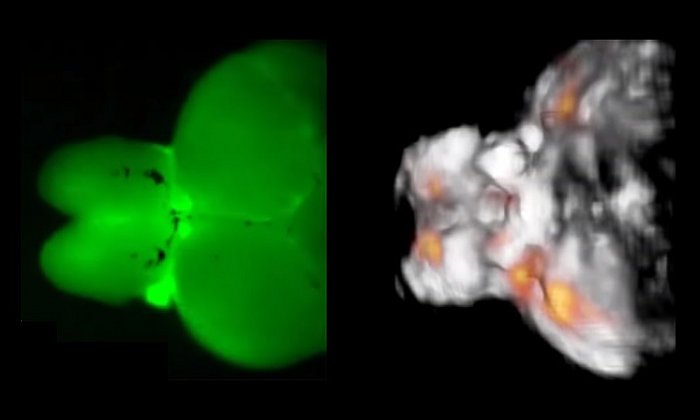
Wenn Licht durch Gewebe strahlt, wird es gestreut. Deshalb werden bei Lichtmikroskopen Bilder schon in weniger als einem Millimeter Tiefe unscharf. Hier liegt der weitere Vorteil der Optoakustik: Ultraschall wird kaum abgelenkt und liefert noch scharfe Bilder in mehreren Zentimetern Tiefe. Gerade für das Gehirn ist das interessant, da bisherige Verfahren nur wenige Millimeter unter die Hirnoberfläche gelangen. Das Gehirn hat aber eine so komplexe dreidimensionale Struktur mit unterschiedlichsten Funktionsbereichen, dass die Oberfläche nur einen kleinen Teil ausmacht. Das Ziel der Forscher ist es deshalb, mit dem neuen Sensor tief im Gewebe Kalziumveränderungen zu messen. Erst Ergebnisse bekamen sie bereits aus den Gehirnen von Zebrafischlarven.
Ungiftig und strahlungsfrei
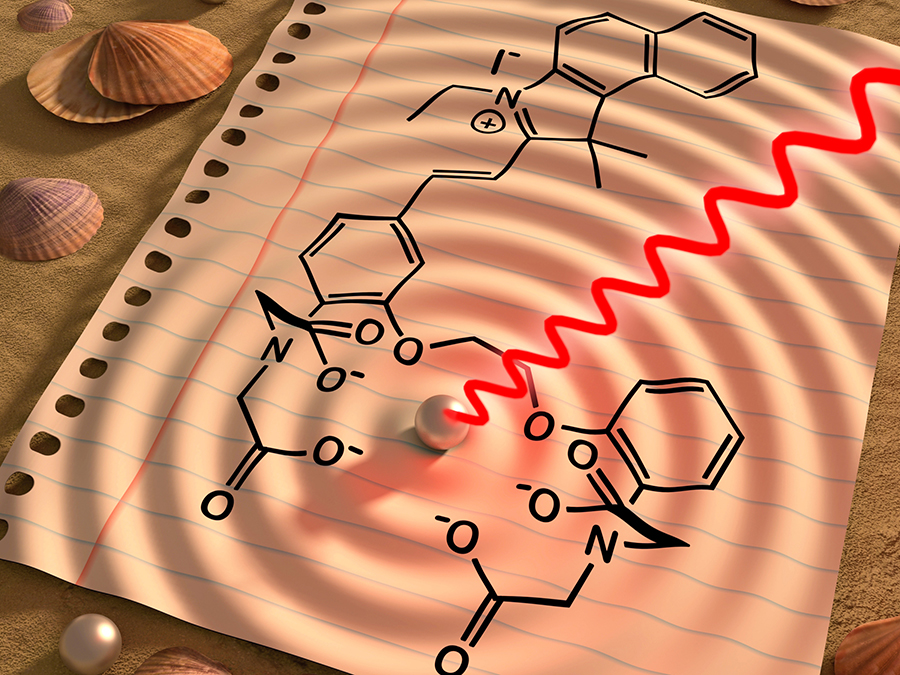
Die Wissenschaftlerinnen und Wissenschaftler haben das Sensormolekül zudem so entworfen, dass es von lebenden Zellen einfach aufgenommen werden kann. Er ist darüber hinaus nicht schädlich für das Gewebe und arbeitet mit einem Farbumschlag. Wenn der Sensor an Kalzium bindet, ändert sich seine Farbe, was wiederum das Licht-induzierte Optoakustiksignal verändert.
Bei vielen bisherigen bildgebenden Verfahren, mit denen sich Kalziumveränderungen sichtbar machen lassen, müssen Zellen genetisch verändert werden. Sie erhalten dann zum Beispiel die Fähigkeit zu leuchten, wenn sich die Menge an Kalzium in der Zelle ändert. Das Problem hierbei ist, dass ein solcher genetischer Eingriff beim Menschen nicht möglich ist. Mit dem neuen Sensor ließe sich diese Limitierung umgehen, sagen die Wissenschaftler. In Zukunft sollen die Eigenschaften des Moleküls aber noch weiter verfeinert werden, so dass die Sensorsignale in noch tieferen Gewebeschichten gemessen werden können. Hierzu muss das Team um Gil Gregor Westmeyer noch weitere Varianten des Moleküls generieren, die im langwelligeren, für Menschen nicht mehr sichtbaren, Bereich des Lichts absorbieren.
Originalpublikation
Roberts S., Seeger M., Jiang Y., Mishra A., Sigmund F., Stelzl A., Lauri A., Symvoulidis P., Rolbieski H., Preller M., Deán-Ben X. L., Razansky D., Orschmann T., Desbordes S., Vetschera P., Bach T., Ntziachristos V., Westmeyer G.G., Calcium Sensor for Photoacoustic Imaging, Journal of the American Chemical Society (JACS), Oktober 2017, DOI: 10.1021/jacs.7b03064
Kontakt
Prof. Dr. Gil Gregor Westmeyer
Technische Universität München
Professor für Molekulare Bildgebung
Tel.: +49 (0) 89 3187-2123
gil.westmeyer@tum.de
Weitere Informationen
Technische Universität München
Corporate Communications Center
- Dr. Vera Siegler
- vera.siegler@tum.de
- presse@tum.de
- Teamwebsite