Neues Tiermodell zur Beobachtung des Transports von Mitochondrien in lebenden Nervenzellen
Durchsichtiger „MitoFish“ eröffnet neue Einblicke in neurologische Erkrankungen
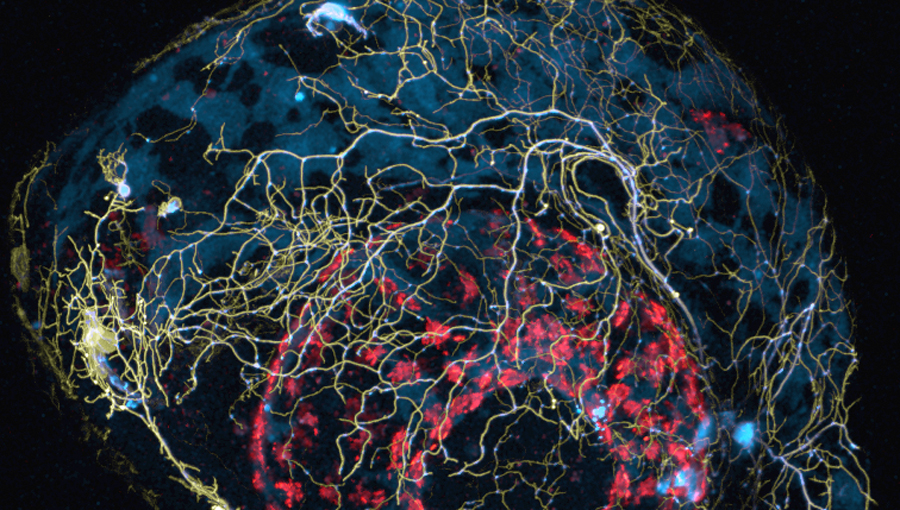
Neurodegenerative Erkrankungen wie die Alzheimer-Erkrankung, Parkinson, ALS (Amyotrophe Lateralsklerose) und MS (Multiple Sklerose) zeigen ganz verschiedene Symptome, und unterscheiden sich in ihrem Verlauf. Auf der Ebene einzelner Neuronen jedoch, kann man bei einer Vielzahl degenerativer Erkrankungen gemeinsame Mechanismen beobachten. Beispielsweise ist eine Beeinträchtigung des Transportes von Mitochondrien in Nervenfasern ein weit verbreitetes Phänomen, das den Abbau von Nervenzellen beschleunigen könnte. Mitochondrien sind essentielle Organellen, die Zellen die notwendige Energie liefern, aber auch andere wichtige Aspekte des zellulären Verhaltens regulieren. Gerade in Nervenzellen, die besonders viel Energie verbrauchen, müssen auch lange Fortsätze, die Axone, mit Energie und daher mit Mitochondrien versorgt werden. Erste Erkenntnisse zum Transport von Mitochondrien bei neurodegenerativer Erkrankungen stammen vor allem aus Mausmodellen. Die Beobachtung von mitochondrialem Transport in Zebrafischen und die Entwicklung eines weiteren Tiermodells — des MitoFish — zur Untersuchung von Mitochondrien, eröffnen jetzt neue Möglichkeiten.
Das neue Modell wurde gemeinsam von Prof. Dr. Thomas Misgeld und Dr. Bettina Schmid entwickelt. Misgeld hat den Lehrstuhl für Biomolekulare Sensoren an der Technischen Universität München inne. Schmid leitet eine Forschergruppe am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) in Kooperation mit Prof. Christian Haass, Ludwig-Maximilians-Universität München (LMU). „Diese Zusammenarbeit hat uns Zugang zu einem Modellsystem gegeben, in dem wir versuchen können, den Lebenszyklus bestimmter Zellorganellen – in diesem Fall der Mitochondrien – direkt in einer lebenden Zelle, die sich in ihrer physiologischen Umgebung entwickelt, zu studieren“, sagt Misgeld. „Viele Aspekte der Organellenbiologie verstehen wir nicht gut genug, um sie in anderen, einfacheren Systemen nachzustellen, sodass wir einfach den Zebrafisch nutzen, der dies quasi für uns erledigt.“
Der MitoFish kann als Tiermodell einfach manipuliert werden. Dieser Umstand ermöglicht es den Forschern, spezielle Fragestellungen zu behandeln. Da die Fische im wahrsten Sinne des Wortes transparent sind, können die für Krankheitsprozesse relevanten Veränderungen in nichtinvasiven Studien untersucht werden. In diesem Modellsystem kann man den Mitochondrientransport innerhalb von intakten, lebenden Neuronen in vivo beobachten. „Der Zebrafisch ist ein etabliertes Modell in der Genetik“, erläutert Schmid: „Das bedeutet, dass wir fremde Gene oder spezifische Proteine in diese Fische einbringen können und damit verschiedene Hypothesen zur Grundlagenforschung, zur Entstehung von Erkrankungen oder auch zu potenziellen Therapien testen können. Weil die Fische in der frühen Embryonalphase durchsichtig sind, kann man einzelne Nervenzellen mit fluoreszierenden Proteinen markieren und sie dann am intakten, lebenden Tier beobachten.“
Die Forscher betonen, dass diese neuen Einblicke in neurodegenerative Erkrankungen ohne das komplementäre Fachwissen beider Kooperationspartner nicht möglich gewesen wären: Die Arbeitsgruppe von Misgeld beschäftigte sich mit der Bildgebung und Analyse des Organellen-transports, während das Labor von Schmid das Modellsystem transgener Zebrafische entwickelte, die stabil genug für Langzeitstudien sind. Die Erstautoren der Publikation im Journal of Neuroscience sind Gabriela Pluci?ska (TUM) und Dominik Paquet (LMU). Misgeld und Schmid, die beiden Leiter dieses Projekts, sind durch Mitgliedschaft im neuen medizinischen Exzellenzcluster SyNergy (Munich Cluster for Systems Neurology) verbunden, sowie im DZNE und im Exzellenzcluster CIPSM.
„Im Gespräch haben wir festgestellt“, erinnert sich Misgeld, „dass dies perfekt zusammenpassen würde – dass Bettina Schmid Fragestellungen bearbeitet, in denen die Art von Transportstudien, an denen ich interessiert war, von Bedeutung sein könnten, und dass sie all die Methoden zur Hand hatte, die nötig waren, um unsere Pläne umzusetzen.“
Die treibende Kraft dahinter sei es, so die Wissenschaftler, die Entstehung der Alzheimer-Krankheit und weiterer Erkrankungen des zentralen Nervensystems besser zu verstehen, um damit die Suche nach neuen Therapien in die richtige Richtung zu lenken. „Wir müssen erst verstehen, wie eine Maschine funktioniert, bevor wir sie bedienen können“, erläutert Schmid und fügt hinzu: „In der modernen Biologie werden derart komplexe Technologien eingesetzt, dass ein einzelnes Labor unmöglich alle notwendigen Sachkenntnise in der nötigen Breite und Tiefe abdecken kann.“
Diese Arbeit wurde unterstützt durch die Deutsche Forschungsgemeinschaft (DFG) über den SFB 596 (Molekulare Mechanismen der Neurodegeneration), das TUM Institute for Advanced Study, die Exzellenzcluster SyNergy (Munich Cluster for Systems Neurology) und CIPSM (Center for Integrated Protein Science Munich); das 7. Forschungsrahmenprogramm der EU (FP7/2007-2013) unter der Grant-Nummer 200611 (MEMOSAD) und durch die Alexander von Humboldt-Stiftung.
Originalpublikation:
Gabriela Plucinska, Dominik Paquet, Alexander Hruscha, Leanne Godinho, Christian Haass, Bettina Schmid, and Thomas Misgeld. In Vivo Imaging of Disease-Related Mitochondrial Dynamics in a Vertebrate Model System. The Journal of Neuroscience, 32(46):16203-16212.
DOI:10.1523/JNEUROSCI.1327-12.2012
Kontakt:
Prof. Thomas Misgeld
Technische Universität München
Chair for Biomolecular Sensors / Institute of Neuroscience
Biedersteinerstr. 29, 80802 Munich, Germany
Tel: +49 (0)89 4140 3512
E-mail: thomas.misgeld@lrz.tum.de
Web: http://www.misgeld-lab.me.tum.de/new/
Dr. Bettina Schmid
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE) Munich
LMU Munich
Adolf Butenandt Institute / Metabolic Biochemistry
Schillerstr. 44, 80336 Munich, Germany
Tel: +49 (0)89 2180 75451
E-mail: beschmid@med.uni-muenchen.de
Web: http://www.biochemie.abi.med.uni-muenchen.de/haass/zebrafish/index.html