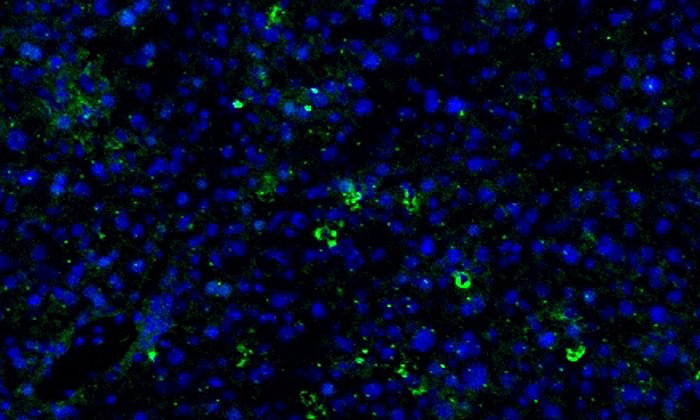
Kinderklinik: Tumor-Wachstum des Ewing Sarkom im Tiermodell verringert
Forscher blockieren Genaktivität von Knochentumor
Die Überlebensrate von Kindern und Jugendlichen mit einem Knochen- oder Weichteilsarkom liegt fünf Jahre nach der Erkrankung bei 60 bis 70 Prozent. Damit konnten die Heilungschancen bei diesen bösartigen Tumoren in den letzten Jahrzehnten bereits deutlich gesteigert werden, insbesondere durch die Arbeiten deutscher Mediziner. Allerdings leiden die Kinder und Jugendlichen stark an den Langzeitfolgen der verstümmelnden und giftigen Behandlungen aus Chirurgie, Chemo- und Strahlentherapie. Zudem ist die Prognose für Patienten mit Metastasen oder Rückfällen weiterhin deutlich schlechter.
Nun hat eine Forschergruppe um den Biochemiker PD Dr. Günther Richter und den Onkologen Prof. Stefan Burdach von der Kinderklinik des Klinikums rechts der Isar der TUM und des Städtischen Klinikums Schwabing in einem mehrjährigen Forschungsprojekt neue Therapie- und Diagnoseansätze für das Ewing Sarkom gefunden. Das Ewing Sarkom ist die zweithäufigste Knochenkrebsart bei Kindern und die dritthäufigste bei Erwachsenen. Häufig sind Becken- und Oberschenkelknochen betroffen. Aber auch Fett-, Muskel- oder Bindegewebe können Ursprungsort des Tumors sein.
Übertragung der Geninformation blockiert
Das Ewing Sarkom wird durch einen Bruch des DNA-Doppelstrangs und dessen fehlerhafte Reparatur ausgelöst. Ein bestimmtes Gen fusioniert an anderer Stelle mit einem anderen Gen. Die Folge ist die Produktion des sogenannten Onkofusionsproteins (EWS-FLI1), das die Entstehung und das Wachstum des Tumors auslöst.
Den Wissenschaftlern der TUM ist es nun im Mausmodell gelungen, die Produktion des Onkofusionsproteins zu stoppen, indem sie die zugrunde liegende Genaktivität entscheidend beeinflussten. Dazu setzten sie ein Molekül (JQ1) ein, das bestimmte Proteine wie zum Beispiel BRD4 blockiert. Ohne dieses Protein kann wiederum die Transkription von DNA zu RNA, also die Übertragung der Geninformation, für die Produktion des Onkofusionsproteins nicht stattfinden. Damit wird auch der Zelltod vorhandener Tumorzellen ausgelöst. Auf diese Weise konnten die Forscher Wachstum und Ausbreitung des Tumors signifikant verringern.
Niedrige Mutationsrate
„Mit diesen Erkenntnissen aus der Epigenetik eröffnen sich Ansätze zur Entwicklung neuer Therapien“, sagt Richter. Wie bedeutsam bei der Entstehung von Krebs nicht nur Veränderungen der Gene selbst, sondern auch Vorgänge der Genaktivität sein können, zeigen auch Ergebnisse aus der Grundlagenforschung des Projektes: Bei einer deutschlandweiten Untersuchung der Tumorproben von mehr als 100 Patienten stellten die Wissenschaftler fest, dass Ewing Sarkome eine sehr niedrige Mutationsrate aufweisen – ebenso wie es von anderen Tumorarten, die Kinder betreffen, bekannt ist. „Dies bestätigt zum einen, dass die Erkrankung nicht nur durch genetische Veränderungen erklärbar ist, und zum anderen, dass in der Krebstherapie für Kinder und Jugendliche neue, spezifische Methoden notwendig sind“, betont Burdach.
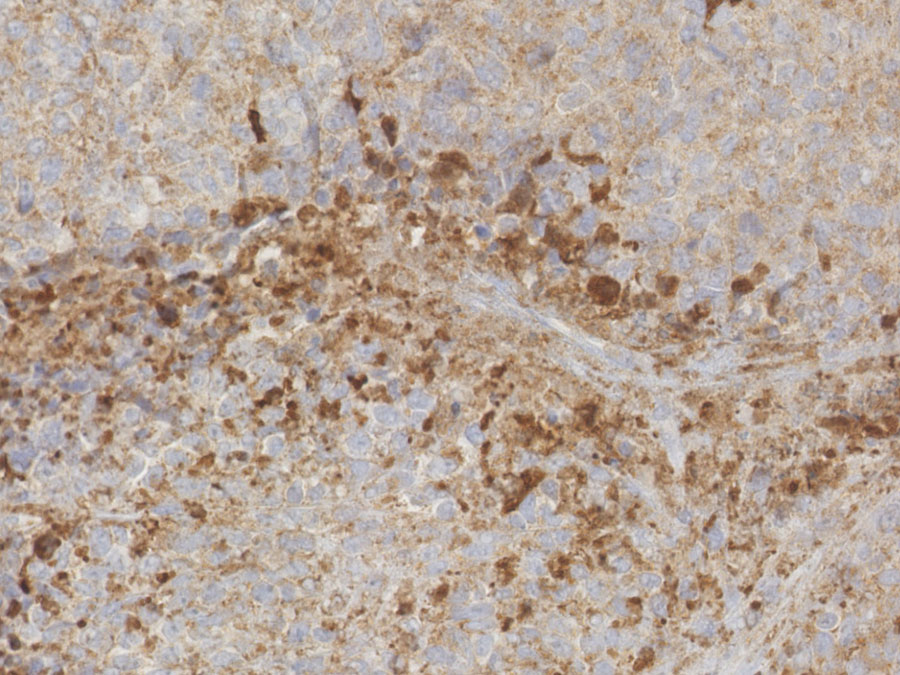
Zwei Proteine als Kandidaten für Tumormarker
Die Forscher des TUM-Klinikums rechts der Isar fanden außerdem Ansätze für eine bessere Diagnose des Ewing Sarkoms. Sie identifizierten bei der Untersuchung der Tumorproben zwei Proteine als mögliche Marker. Erstens stellten sie fest, dass das sogenannte DKK2-Protein eine wesentliche Rolle bei der Infiltration und Auflösung des Knochens durch die Tumorzellen spielt. „Wir prüfen derzeit in einer europaweiten Studie, ob sich DKK2 als Charakteristikum für ein invasives Knochenwachstum des Ewing Sarkoms bestätigt“, sagt Richter. Deutlich hochreguliert war zweitens das GPR64-Protein, das auf der Oberfläche der Tumorzellen zu finden ist und diese unempfindlich gegen einen durch Medikamente oder Sauerstoffmangel ausgelösten Zelltod macht. Es ist damit ebenfalls ein Kandidat für die Diagnostik.
Hintergrund:
Die Forscher gehören zur Wilhelm Sander-Therapieeinheit für Knochen- und Weichteilsarkome (Muskuloskelettales Tumorzentrum) des Klinikums rechts der Isar der TU München. Die Wilhelm Sander-Stiftung fördert vier Forschungsprojekte der Gruppe mit dem Ziel, die Diagnostik zu verbessern und individuelle Therapien für Patienten zu entwickeln, die mit herkömmlichen Behandlungsstrategien nicht geheilt werden können. Das hier beschriebene Forschungsprojekt hat die Stiftung mit rund 170.000 Euro über fünf Jahre unterstützt.
Publikationen:
Hensel T, Giorgi G, Schmidt O, Calzada-Wack J, Neff F, Buch T, Niggli FK, Schäfer BW, Burdach S, Richter GHS (2016). Targeting the EWS-ETS transcriptional program by BET bromodomain inhibition in Ewing sarcoma. Oncotarget 7(2): 1451-63. DOI: 10.18632/oncotarget.6385
Agelopoulos K, Richter GHS, Schmidt E, Dirksen U, von Heyking K, Moser B, Klein HU, Kontny U, Dugas M, Poos K, Korsching E, Buch T, Weckesser M, Schulze I, Besoke R, Witten A, Stoll M, Köhler G, Hartmann W, Wardelmann E, Rössig C, Baumhoer D, Jürgens H, Burdach S, Berdel WE, Müller-Tidow C (2015). Deep sequencing in conjunction with expression and functional analyses reveals activation of FGFR1 in Ewing sarcoma. Clin Cancer Res. 21(21); 4935–46. DOI: 10.1158/1078-0432.CCR-14-2744
Richter GHS, Fasan A, Hauer K, Grunewald TGP, Berns C, Rössler S, Naumann I, Staege MS, Fulda S, Esposito I, Burdach S (2013). G-Protein coupled receptor 64 promotes invasiveness and metastasis in Ewing sarcomas through PGF and MMP1. J Pathol. May; 230(1): 70-81. DOI: 10.1002/path.4170
Hauer K, Julia Calzada-Wack J, Steiger K, Grunewald TG, Baumhoer D, Plehm S, Buch T, Prazeres da Costa O, Esposito I, Burdach S, Richter GHS (2013). DKK2 mediates osteolysis, invasiveness and metastatic spread in Ewing sarcoma. Cancer Res. 73(2): 967-77. DOI: 10.1158/0008-5472.CAN-12-1492
Kontakt:
PD Dr. Günther Richter
Kinderklinik des Klinikums rechts der Isar der Technischen Universität München
Labor für Funktionelle Genomik & Transplantationsbiologie im Forschungszentrum für krebskranke Kinder
Tel: +49 89 3068 3235
guenther.richter@tum.de
www.kinderklinik-muenchen-schwabing.de
Hochauflösende Bilder im Download-Portal:
Technische Universität München
Corporate Communications Center
- Klaus Becker
- klaus.becker@tum.de
- presse@tum.de
- Teamwebsite